Definición de isobaros
 El vocablo griego isobarḗs, que hace referencia a aquello “de igual peso”, llegó al francés como isobare. A nuestro idioma arribó como isobaro o isóbaro, según acepta la Real Academia Española (RAE).
El vocablo griego isobarḗs, que hace referencia a aquello “de igual peso”, llegó al francés como isobare. A nuestro idioma arribó como isobaro o isóbaro, según acepta la Real Academia Española (RAE).
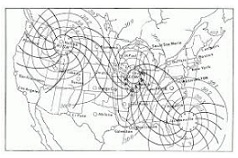
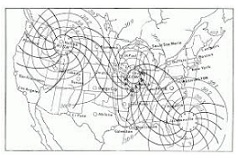
El concepto se emplea en el ámbito de la meteorología para nombrar a dos o más sitios que presentan la misma presión atmosférica media. También se llama isobaro a la línea que, en un mapa meteorológico, permite unir a aquellos lugares que tienen idéntica presión atmosférica en un momento específico.
Para comprender qué son los isobaros, de este modo, hay que centrarse primero en la noción de presión atmosférica. Así se denomina a la presión ejercida por la atmósfera sobre la totalidad de los cuerpos que se encuentran en ella. La presión atmosférica considerada normal es de 1013 mbar o 760 mm Hg al nivel del mar.
En el terreno de la química, por otra parte, los isóbaros son aquellos átomos que tienen el mismo número de masa, aunque distinto número atómico. Esto quiere decir que se trata de átomos de diversos elementos químicos, con propiedades químicas diferentes. Además, provienen de distintos elementos químicos.
El número de masa o número másico refleja la suma de la cantidad de protones y de neutrones que hay en el núcleo del átomo. El número atómico, en tanto, refiere específicamente a la cantidad de protones.
Es necesario señalar que la cantidad neta de protones y neutrones que se encuentran en cada núcleo no varía. En otras palabras, el origen de una especie isóbara tiene lugar cuando dos núcleos atómicos exhiben el mismo número neto de protones y neutrones para sus respectivas especies.
A pesar de ello, la cantidad de protones y neutrones que forman parte de dicho total es diferente. Para poder visualizar esto de manera gráfica es posible echar un vistazo al número másico, que en la tabla periódica lo encontramos en la esquina superior izquierda de los símbolos de los elementos químicos: en dos isóbaros, este valor es idéntico.
Es importante no confundir los isóbaros con los isótopos. Los isótopos son átomos con el mismo número atómico y distinto número de masa (al revés que los isóbaros): por eso tienen las mismas propiedades químicas y pertenecen al mismo elemento químico. Los isótonos, asimismo, disponen de distinto número atómico y distinto número de masa.
 Con respecto a la etimología de la palabra isóbaro, su origen nos remonta a la lengua griega, donde encontramos los componentes isos y baros, que significan «igual» y «pesos«, respectivamente. Esto nos remite una vez más a la igualdad de pesos que existe entre los pares de especies nucleares que pueden clasificarse de esta manera. Podemos observar el primero de dichos componentes en los otros términos relacionados.
Con respecto a la etimología de la palabra isóbaro, su origen nos remonta a la lengua griega, donde encontramos los componentes isos y baros, que significan «igual» y «pesos«, respectivamente. Esto nos remite una vez más a la igualdad de pesos que existe entre los pares de especies nucleares que pueden clasificarse de esta manera. Podemos observar el primero de dichos componentes en los otros términos relacionados.
Otra de las especies con la cual los isóbaros tienen algunas similitudes con respecto a sus núcleos es la de los isótonos, que se mencionan brevemente en un párrafo anterior. Entre las coincidencias que tienen se encuentra la cantidad de neutrones, que es igual; sin embargo, el número atómico y el de masa son diferentes, algo que se puede apreciar en varios pares de elementos.
También debemos tener en cuenta la palabra nucleido, que se utiliza para denominar los diferentes grupos posibles de nucleones, las estructuras que están formadas por protones y neutrones. Los nucleidos, por lo tanto, pueden diferenciarse por el número de protones o neutrones, o también por la cantidad de energía que se aprecie en la estructura de su conglomeración.
El uso del término isóbaros para denotar especies consideradas nucleidos con el mismo número de nucleones (o sea, que tengan el mismo número de masa) la propuso un químico oriundo de Gran Bretaña llamado Alfred Walter Stewart en la década de 1910.
