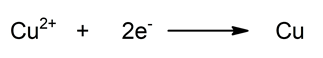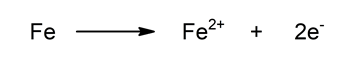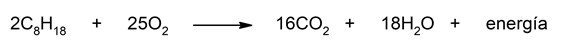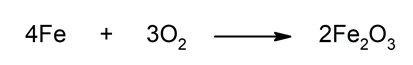Reacciones redox
Te explicamos qué son las reacciones redox, los tipos que existen, sus aplicaciones, características y ejemplos de reacciones redox.
¿Qué son las reacciones redox?
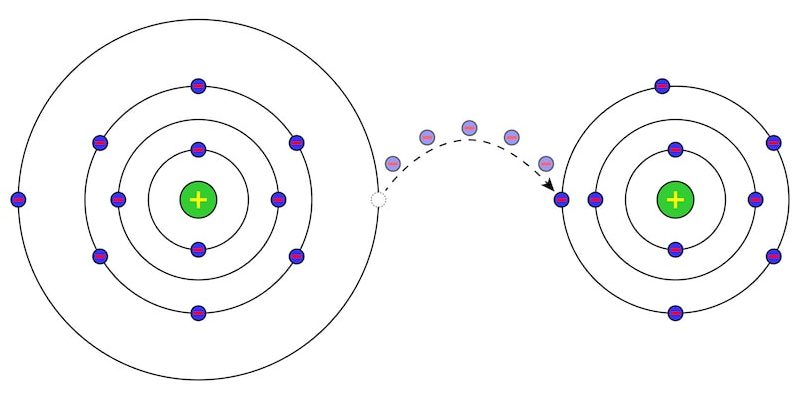
En química, se conoce como reacciones redox, reacciones óxido-reducción o reacciones reducción-oxidación a las reacciones químicas en las que ocurre un intercambio de electrones entre los átomos o moléculas involucrados.
Ese intercambio se refleja en el cambio de estado de oxidación de los reactivos. El reactivo que cede electrones experimenta oxidación y el que los recibe, reducción.
El estado de oxidación indica la cantidad de electrones que un átomo de un elemento químico cede o acepta cuando forma parte de una reacción química. Se puede interpretar también como la supuesta carga eléctrica que tendría determinado átomo si todos sus enlaces con otros átomos fuesen completamente iónicos. También se denomina número de oxidación o valencia.
El estado de oxidación se expresa en números enteros, siendo cero el estado de oxidación para los elementos neutros. Así, puede tomar valores positivos o negativos dependiendo del tipo de átomo y de la reacción donde participe. Por otra parte, algunos átomos tienen estados de oxidación variables según la reacción en que estén involucrados.
Saber determinar correctamente el estado o número de oxidación de cada átomo en un compuesto químico es indispensable para poder entender y analizar las reacciones redox. Existen determinadas reglas que permiten calcular sus valores:
- El número de oxidación de los elementos o moléculas neutras es cero. Por ejemplo: metales sólidos (Fe, Cu, Zn…), moléculas (O2, N2, F2).
- Los iones compuestos por un solo átomo tienen su número de oxidación igual a su carga. Por ejemplo: Na+, Li+, Ca2+, Mg2+, Fe2+, Fe3+, Cl–.
- El flúor siempre tiene estado de oxidación -1 porque es el elemento más electronegativo que existe (F–).
- El hidrógeno siempre tiene número de oxidación +1 (H+), con excepción de los hidruros metálicos (hidruro de potasio, KH), donde tiene número de oxidación -1 (H–).
- El oxígeno tiene número de oxidación -2, salvo algunas excepciones:
- Cuando forma compuestos con flúor tiene número de oxidación 2+. Por ejemplo: difluoruro de oxígeno (OF2).
- Cuando forma peróxidos tiene número de oxidación -1 (O22-). Por ejemplo: peróxido de hidrógeno (H2O2), peróxido de sodio (Na2O2).
- Cuando forma superóxidos tiene número de oxidación -½ (O2–). Por ejemplo: superóxido de potasio (KO2).
- La suma algebraica de los números de oxidación de los átomos que constituyen un compuesto neutro es cero.
- La suma algebraica de los números de oxidación de los átomos que constituyen un ión poliatómico es igual a la carga del ión. Por ejemplo: el anión sulfato (SO42-) tiene número de oxidación -2, el cual es igual a la suma de los números de oxidación del azufre y del oxígeno, cada uno multiplicado por la cantidad de cada átomo en el compuesto, en este caso, tiene un átomo de azufre y cuatro átomos de oxígeno.
- Los números de oxidación de algunos elementos químicos pueden variar dependiendo del compuesto neutro o ion del que formen parte. Entonces, es posible calcular el número de oxidación de un átomo en un compuesto de la siguiente forma:
![]()
Donde no() significa número de oxidación, y el elemento químico se encuentra dentro de los paréntesis.
De esta manera, en toda reacción redox hay dos tipos de reactivos, uno que cede electrones y otro que los acepta:
- Un agente oxidante. Es el átomo que capta los electrones. En este sentido, disminuye su estado de oxidación inicial, y se experimenta una reducción. De esta forma, aumenta su carga eléctrica negativa al ganar electrones.
- Un agente reductor. Es el átomo que cede los electrones y aumenta su estado de oxidación inicial, experimentando una oxidación. De esta forma, aumenta su carga eléctrica positiva al ceder electrones.
Algunos elementos químicos pueden oxidarse y reducirse a la vez. A estos elementos se les llaman anfolitos y el proceso en el cual sucede esto se denomina anfolización.
Las reacciones redox son unas de las reacciones químicas más comunes del universo, pues forman parte de los procesos de fotosíntesis en las plantas y de la respiración en los animales, que permiten la continuidad de la vida.
Puede servirte: Comburente
Características de las reacciones redox
Las reacciones redox se encuentran a nuestro alrededor a diario. La oxidación de los metales, la combustión del gas en la cocina o incluso la oxidación de la glucosa para obtener ATP en nuestro organismo son algunos ejemplos.
En la mayoría de los casos, las reacciones redox liberan una importante cantidad de energía.
Por lo general, cada reacción redox está compuesta por dos etapas o semirreacciones. En una de las semirreacciones ocurre la oxidación (el reactivo se oxida) y en la otra ocurre la reducción (el reactivo se reduce).
La reacción redox total, que se obtiene como resultado de combinar algebraicamente todas las semirreacciones, se suele llamar “reacción global”. Es importante tener en cuenta que cuando se combinan algebraicamente las semireacciones, se debe ajustar tanto la masa como la carga. Es decir, la cantidad de electrones cedidos durante la oxidación debe ser la misma que la cantidad de electrones ganados durante la reducción, y la masa de cada reactivo debe ser igual a la masa de cada producto.
Por ejemplo:
- Semireacción de reducción. Reducción del cobre al captar dos electrones. Disminuye su estado de oxidación.
![]()
- Semireacción de oxidación. Oxidación del hierro al perder dos electrones. Aumenta su estado de oxidación.
![]()
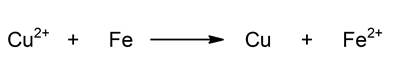
Reacción global:
![]()
Tipos de reacciones redox
Existen distintos tipos de reacciones redox, dotados de características distintas. Los tipos más comunes son:
- Combustión. Las combustiones son reacciones químicas redox que liberan una importante cantidad de energía en forma de calor y luz. Estas reacciones son oxidaciones rápidas que desprenden mucha energía. La energía liberada puede ser utilizada de forma controlada para generar movimiento en los motores de los autos. En estas reacciones participa un elemento llamado comburente (que se reduce y oxida al combustible) y un elemento combustible (que se oxida y reduce al comburente). Algunos ejemplos de combustibles son la gasolina y el gas que usamos en nuestras cocinas, mientras que el comburente más conocido es el oxígeno gaseoso (O2).
- Oxidación de metales. Son reacciones más lentas que las combustiones. Son descritas comúnmente como la degradación de ciertos materiales, especialmente metálicos, por acción del oxígeno sobre ellos. Es un fenómeno mundialmente conocido y cotidiano, especialmente en las poblaciones costeras, donde las sales del ambiente aceleran (catalizan) la reacción. Es por eso que un automóvil, luego de llevarnos a la playa, debe ser limpiado de todo rastro de agua salada.
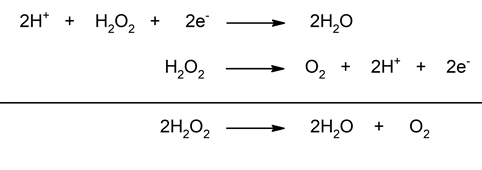
- Desproporción. También conocidas como reacciones de dismutación, presentan un único reactivo que se reduce y se oxida al mismo tiempo. Un caso típico de esto es la descomposición del agua oxigenada (H2O2).
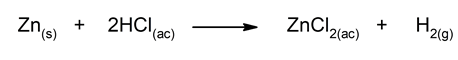
- Desplazamiento simple. También llamadas “reacciones de sustitución simple”, ocurren cuando dos elementos intercambian sus lugares respectivos dentro de un mismo compuesto. Es decir, un elemento sustituye a otro en su exacto lugar de la fórmula, balanceando sus respectivas cargas eléctricas con otros átomos según convenga. Un ejemplo es lo que ocurre cuando un metal desplaza al hidrógeno en un ácido y se forman sales, como ocurre cuando las baterías de un aparato se descomponen.
Ejemplos de reacciones redox
Los ejemplos de reacciones redox son muy abundantes. Trataremos de dar un ejemplo de cada uno de los tipos anteriormente descritos:
- La combustión del octano. El octano es un hidrocarburo componente de la gasolina utilizada para que funcione el motor de nuestros automóviles. Cuando el octano reacciona con el oxígeno, se oxida el octano y se reduce el oxígeno, liberándose una gran cantidad de energía como resultado de esta reacción. Esta energía liberada se utiliza para generar trabajo en el motor, produciendo además dióxido de carbono y vapor de agua en el proceso. La ecuación que representa esta reacción es:
![]()
- La descomposición del peróxido de hidrógeno. Es una reacción de dismutación en la que el peróxido de hidrógeno se descompone en sus elementos constitutivos, agua y oxígeno. En esta reacción el oxígeno se reduce disminuyendo su número de oxidación desde -1 (H2O2) hasta -2 (H2O), y se oxida aumentando su número de oxidación desde -1 (H2O2) hasta 0 (O2).
![]()
- Desplazamiento de la plata por cobre. Es una reacción de desplazamiento simple en la que se puede ver cómo al sumergir un fragmento de cobre metálico en una disolución de nitrato de plata, el color de la disolución se torna azul y se deposita una delgada capa de plata metálica sobre el fragmento de cobre. En este caso, parte del cobre metálico (Cu) se transforma en el ión Cu2+, como parte del nitrato de cobre (II) (Cu(NO3)2), cuya disolución tiene un lindo color azul. Por otra lado, parte del catión Ag+, que forma parte del nitrato de plata (AgNO3), se transforma en plata metálica (Ag) que se deposita.
![]()
- Reacción de zinc con ácido clorhídrico diluido. Es una reacción de desplazamiento simple en la que el hidrógeno del HCl(ac) es desplazado por el zinc para formar una sal.
![]()
- Oxidación del hierro. El hierro metálico se oxida al ponerse en contacto con el oxígeno del aire. Esto se ve en la vida diaria cuando sobre los objetos de hierro se forma una capa de óxido marrón al ser expuestos por mucho tiempo al aire. En esta reacción el hierro metálico (Fe), que tiene estado de oxidación 0, se transforma en Fe3+ , es decir, aumenta su estado de oxidación (se oxida). Por esta razón, se dice intuitivamente o coloquialmente: el hierro se oxida.
![]()
Aplicaciones industriales

Las aplicaciones industriales de las reacciones redox son infinitas. Por ejemplo, las reacciones de combustión son idóneas para producir trabajo que sirve para generar movimiento en los grandes motores que se utilizan en las plantas eléctricas para producir electricidad.
El proceso consiste en quemar combustibles fósiles para obtener calor y producir vapor de agua en una caldera, luego este vapor de agua se usa para mover grandes motores o turbinas. Por otra parte, las reacciones de combustión también son utilizadas para que funcione el motor de los vehículos motores que utilizan combustibles fósiles, como nuestros autos.
Por otro lado, reacciones redox de sustitución y desplazamiento son útiles para obtener ciertos elementos en un estado de pureza que no es frecuente ver en la naturaleza. Por ejemplo, la plata es sumamente reactiva. Aunque es poco frecuente encontrarla pura en el subsuelo mineral, sí puede obtenerse un alto grado de pureza a través de una reacción redox. Lo mismo ocurre a la hora de obtener sales y otros compuestos.
Sigue con: Metabolismo
Referencias
- “Reducción-oxidación” en Wikipedia.
- “Reacciones redox: química” (video) en Educatina.
- “Reacciones de oxidación-reducción (redox)” en Khan Academy.
- “Redox Reactions: Crash Course” (video) en CrashCourse.
- “Oxidation-reduction reaction” en The Encyclopaedia Britannica.