Comburente
Te explicamos qué es un comburente, en qué reacciones interviene y algunos ejemplos. El combustible y la energía de activación.

¿Qué es un comburente?
Un comburente u oxidante es una sustancia o compuesto químico que tiene la propiedad de reducirse, es decir, de ganar electrones, cuando forma parte de una reacción electroquímica o de óxido-reducción. Se trata de compuestos químicos que oxidan a otros con los que reaccionan, quitándoles electrones.
En este tipo de reacciones, conocidas como redox, se dan los dos procesos simultáneamente: la oxidación de un compuesto (el combustible) y la reducción del otro (el comburente). Todos los compuestos involucrados tienen un estado de oxidación, y suele liberarse energía mientras ocurre la reacción, o sea, se trata de una reacción exotérmica. El clásico ejemplo de este tipo de reacciones es la combustión.
El comburente más conocido de todos es el oxígeno, indispensable en prácticamente todas las formas de combustión, y presente en la atmósfera terrestre en proporciones de hasta un 21 %. Es por esa razón que no podemos encender un fuego sin una mínima presencia de aire, pues el aire es una mezcla de oxígeno y otros gases.
Ver también: Fenómenos químicos
Ejemplos de comburente
Algunos agentes oxidantes o comburentes conocidos son los siguientes:
- El oxígeno (O). Es el comburente más usual del planeta Tierra. De hecho, lo empleamos en nuestro organismo para oxidar las moléculas de glucosa de los alimentos y así obtener energía química para mantenernos con vida.
- Las lejías. Como el hipoclorito (ClO–) y otros hipohalitos, así como cloritos (ClO2–), cloratos (ClO3–) y compuestos halógenos semejantes.
- El agua oxigenada. Conocida como peróxido de hidrógeno (H2O2).
- Las sales de permanganato. Por ejemplo, el permanganato de potasio (KMnO4).
- Los sulfóxidos. Por ejemplo, el ácido peroxosulfúrico (H2SO5).
- El reactivo de Tollens. Un complejo acuoso de diamina-plata que se emplea en laboratorios, justamente, como oxidante.
- La mayoría de los compuestos que contienen Cerio (IV).
Comburente y combustible
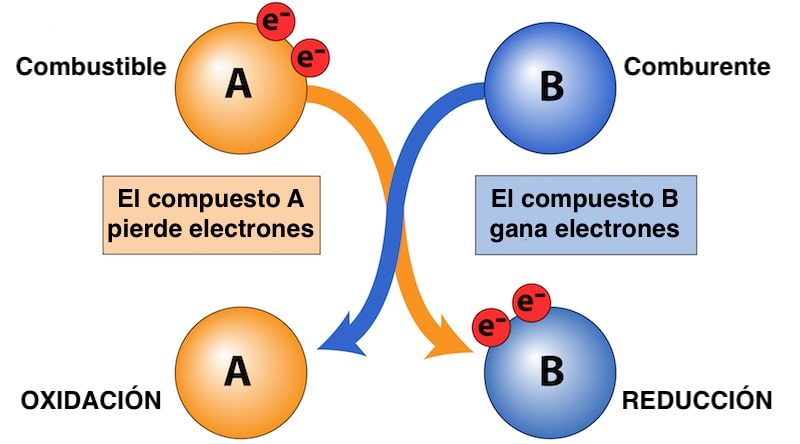
Si el comburente es el compuesto que gana electrones durante la reacción redox, el combustible es la sustancia que cede electrones y se oxida, a diferencia del comburente (que se reduce).
Al hacerlo, el combustible libera como calor parte de su energía química, permitiendo así que ocurra, por ejemplo, una combustión. Tanto combustible como comburente son indispensables para que se den este tipo de reacciones químicas.
Algunos combustibles típicos son el carbón, la madera, los hidrocarburos, la gasolina, el gas natural, etc.
Energía de activación

La energía de activación es una carga mínima de energía inicial que dispara la reacción. Es el último elemento necesario para que se produzca una combustión, aparte del combustible y el comburente.
Por sí solos, combustible y comburente no suelen reaccionar, pero si añadimos una carga adicional de energía, en forma de calor, desataremos la combustión hasta haberse consumido el combustible.
Un claro ejemplo es el encendido de una fogata. Tenemos el combustible (la madera), el comburente (el oxígeno del aire), pero nos falta encender un fósforo o cerillo para poder dar inicio a la combustión.
Lo mismo ocurre con un encendedor: tenemos el combustible (el gas licuado), el comburente (el oxígeno del aire) y requerimos únicamente de la energía adicional del chispazo, producido por el giro de la rueda sobre el mechero.
Sigue con: Riesgo químico
Referencias
- “Oxidante” en Wikipedia.
- “Comburente” en Enciclopedia.es.
- “Combustible, comburente y energía de activación” en Expower.
- “Comburente” en Previpedia.
- “Combustible. Comburente. Calor” en Construmática, Metaportal de Arquitectura, Ingeniería y Construcción.
