Topoisomerasas: características, funciones, tipos e inhibidores
Las topoisomerasas son un tipo de enzimas isomerasas que modifican la topología del ácido desoxirribonucleico (ADN), generando tanto su desenrollamiento como su enrollamiento y superenrollamiento.
Estas enzimas tienen un papel específico en el alivio de la tensión torsional en el ADN para que puedan ocurrir procesos tan importantes como su replicación, la transcripción del ADN en ácido ribonucleico mensajero (ARNm) y la recombinación del ADN.
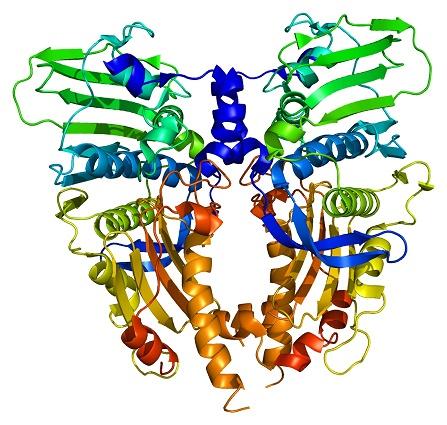
Las enzimas topoisomerasas se encuentran presentes tanto en células eucariotas como en células procariotas. Su existencia fue predicha por los científicos Watson y Crick, al evaluar las limitaciones que la estructura del ADN presentaba para permitir el acceso a su información (almacenada en su secuencia de nucleótidos).
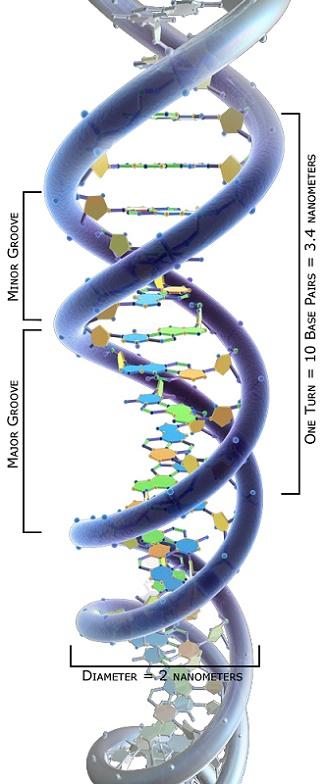
Para comprender las funciones de las topoisomerasas, se debe considerar que el ADN tiene una estructura estable de doble hélice, con sus cadenas enrolladas una sobre la otra.
Estas cadenas lineales están constituidas por 2-desoxiribosas unidas por enlaces fosfodiéster 5´-3´, y bases nitrogenadas en su interior, como los peldaños de una escalera en forma de caracol.
El estudio topológico de las moléculas de ADN ha demostrado que estas pueden asumir varias conformaciones dependientes de su tensión de torsión: desde un estado relajado, hasta diferentes estados de enrollamiento que permiten su compactación.
Las moléculas de ADN con diferentes conformaciones son llamadas topoisómeros. Así, podemos concluir que las topoisomerasas I y II, pueden aumentar o disminuir la tensión de torsión de las moléculas de ADN, formando sus diferentes topoisómeros.
Entre los topoisómeros del ADN posibles, la conformación más común es la de superenrollamiento, la cual es muy compacta. Sin embargo, la doble hélice del ADN debe ser también desenrollada por las topoisomerasas durante varios procesos moleculares.
Índice del artículo
- 1 Características
- 2 Funciones
- 3 Tipos de topoisomerasas
- 4 Inhibidores de las topoisomerasas
- 5 Referencias
Algunas topoisomerasas pueden relajar solamente superenrollamientos negativos del ADN, o ambos superenrollamientos del ADN: positivos y negativos.
Si el ADN bicatenario circular se desenrolla sobre su eje longitudinal y se produce una vuelta levógira (en sentido de las agujas del reloj), se dice que está superenrollada negativamente. Si la vuelta resulta dextrógira (en sentido contrario a las agujas del reloj), está superenrollada positivamente.

Básicamente, las topoisomerasas pueden:
-Facilitar el paso de una hebra de ADN a través de un corte en la hebra opuesta (topoisomerasa tipo I).
-Facilitar el paso de una doble hélice completa a través de una escisión en sí misma, o a través de una escisión en otra doble hélice diferente (topoisomerasa tipo II).
En resumen, las topoisomerasas actúan a través de la escisión de enlaces fosfodiéster, en una o en las dos hebras que componen el ADN. Luego modifican el estado de enrollamiento de las hebras de una doble hélice (topoisomerasa I) o de dos dobles hélices (topoisomerasa II), para finalmente volver a empatar o ligar los extremos escindidos.
Aunque la topoisomerasa I es una enzima que presenta mayor actividad durante la fase S (síntesis de ADN), no se considera que sea dependiente de una fase del ciclo celular.
Mientras que la actividad topoisomerasa II es más activa durante la fase logarítmica del crecimiento celular y en las células de los tumores de crecimiento rápido.
La alteración de los genes que codifican las topoisomerasas resulta letal para las células, evidenciando la importancia de estas enzimas. Entre los procesos en los cuales las topoisomerasas participan, se encuentran:
Las topoisomerasas facilitan el almacenamiento de información genética de manera compacta, debido a que generan el enrollamiento y superenrollamiento del ADN, permitiendo que gran cantidad de información se encuentre en un volumen relativamente pequeño.
Si no existieran las topoisomerasas y sus características únicas, sería imposible el acceso a la información almacenada en el ADN. Esto se debe a que las topoisomerasas liberan periódicamente la tensión por torsión que se genera en la doble hélice de ADN, durante su desenrollamiento, en los procesos de replicación, transcripción y recombinación.
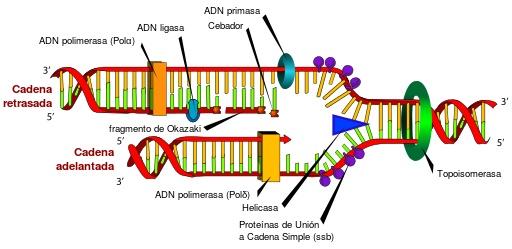
De no liberarse la tensión por torsión generada durante estos procesos, se podría producir una expresión génica defectuosa, la interrupción del ADN circular o cromosoma, incluso produciéndose la muerte celular.
Los cambios conformacionales (en la estructura tridimensional) de la molécula de ADN, exponen al exterior regiones específicas, que pueden interactuar con proteínas de unión al ADN. Estas proteínas tienen una función reguladora de la expresión genética (positiva o negativa).
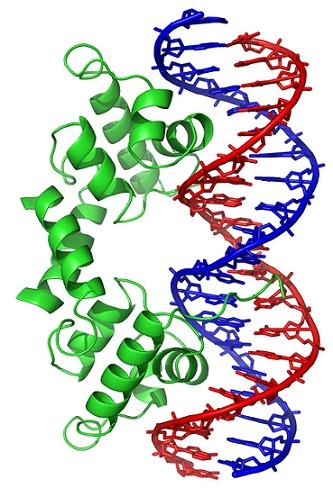
Así, el estado de enrollamiento del ADN, generado por acción de las topoisomerasas, afecta la regulación de la expresión genética.
La topoisomerasa II es necesaria para el ensamblaje de las cromátidas, la condensación y descondensación de los cromosomas y la segregación de moléculas hijas de ADN durante la mitosis.
Esta enzima es también una proteína estructural y uno de los principales constituyentes de la matriz del núcleo celular durante la interfase.
Existen dos tipos principales de topoisomerasas dependiendo de si son capaces de escindir una o dos cadenas de ADN.
Monoméricas
Las topoisomerasas de tipo I son monómeros que alivian superenrollamientos negativos y positivos, que se producen por el movimiento de la horquilla durante la transcripción, y durante los procesos de replicación y de recombinación génica.
Las topoisomerasas tipo I se pueden subdividir en tipo 1A y tipo 1B. Estas últimas son las que se encuentran en los humanos, y son responsables de relajar el ADN superenrollado.
Tirosina en su sitio activo
La topoisomerasa 1B (Top1B) está formada por 765 aminoácidos divididos en 4 dominios específicos. Uno de estos dominios presenta un área altamente conservada que contiene el sitio activo con tirosina (Tyr7233). Todas las topoisomerasas presentan en su sitio activo una tirosina con un papel fundamental en todo el proceso catalítico.
Mecanismo de acción
La tirosina del sitio activo forma un enlace covalente con el extremo 3´-fosfato de la cadena del ADN, cortándola y manteniéndola unida a la enzima, mientras pasa otra hebra de ADN a través de la escisión.
El paso de la otra hebra de ADN a través de la hebra escindida, se logra gracias a una transformación conformacional de la enzima, que produce la apertura de la doble hélice del ADN.
Después la topoisomerasa I regresa a su conformación inicial y liga nuevamente los extremos escindidos. Esto ocurre por un proceso inverso a la ruptura de la cadena de ADN, en el sitio catalítico de la enzima. Finalmente, la topoisomerasa libera la hebra de ADN.
La tasa de ligación del ADN es mayor a la tasa de escisión, con lo cual se asegura la estabilidad de la molécula y la integridad del genoma.
En resumen, la topoisomerasa tipo I cataliza:
- La escisión de una hebra.
- El paso de la otra hebra a través de la escisión.
- La ligación de los extremos escindidos.
Diméricas
Las topoisomerasas del tipo II son enzimas diméricas, que escinden ambas cadenas del ADN, relajando así los superenrollamientos que se generan durante la transcripción y otros procesos celulares.
Dependientes de Mg++ y ATP
Estas enzimas necesitan magnesio (Mg++) y además necesitan la energía que proviene de la ruptura del enlace trifosfato del ATP, que aprovechan gracias a una ATPasa.
Dos sitios activos con tirosina
Las topoisomerasas II humanas son muy similares a las de la levadura (Saccharomyces cerevisiae), la cual está conformada por dos monómeros (subfragmentos A y B). Cada monómero presenta un dominio ATPasa, y en un subfragmento el sitio activo tirosina 782, a la que puede unirse el ADN. Por tanto, pueden unirse dos hebras de ADN a la topoisomerasa II.
Mecanismo de acción
El mecanismo de acción de la topoisomerasa II es igual al descrito para la topoisomerasa I, considerando que se escinden dos cadenas de ADN y no solamente una.
En el sitio activo de la topoisomerasa II se estabiliza (a través de una unión covalente con tirosina) un fragmento de doble hélice de ADN, llamado “fragmento G”. Este fragmento es escindido y mantenido unido al sitio activo por enlaces covalentes.
Luego, la enzima permite que otro fragmento de ADN, llamado “fragmento T”, pase a través del fragmento escindido “G”, gracias a un cambio conformacional de la enzima, el cual es dependiente de la hidrólisis de ATP.
La topoisomerasa II liga los dos extremos del “fragmento G” y finalmente recupera su estado inicial, liberando al fragmento “G”. Entonces, el ADN relaja la tensión de torsión, permitiendo que ocurran los procesos de replicación y transcripción.
El genoma humano tiene cinco topoisomerasas: top1, top3α, top3β (del tipo I); y top2α, top2β (del tipo II). Las topoisomerasas humanas más relevantes son la top1 (topoisomerasa tipo IB) y la 2α (topoisomerasa tipo II).
Debido a que los procesos catalizados por las topoisomerasas son necesarios para la sobrevivencia de las células, estas enzimas son buen blanco de ataque para afectar las células malignas. Por esto, las topoisomerasas se consideran importantes en el tratamiento de muchas enfermedades humanas.
Los fármacos que interactúan con las topoisomerasas son actualmente muy estudiados como sustancias quimioterapéuticas contra células cancerosas (en diferentes órganos del cuerpo) y microorganismos patógenos.
Los fármacos inhibidores de la actividad topoisomerasa, pueden:
- Intercalarse en el ADN.
- Afectar la enzima topoisomerasa.
- Intercalarse en una molécula cercana al sitio activo de la enzima mientras el complejo ADN-topoisomerasa se encuentra estabilizado.
La estabilización del complejo transitorio que se forma por la unión del ADN a la tirosina del sitio catalítico de la enzima, impide la unión de los fragmentos escindidos, lo cual puede conducir a la muerte celular.
Entre los compuestos que inhiben las topoisomerasas, se encuentran los siguientes.
Antibióticos antitumorales
Los antibióticos son usados contra el cáncer, dado que impiden el crecimiento de las células del tumor, generalmente interfiriendo con su ADN. Suelen denominarse antibióticos antineoplásicos (contra el cáncer). La actinomicina D, por ejemplo, afecta la topoisomerasa II y se emplea en tumores de Wilms en niños y en rabdomiosarcomas.
Antraciclinas
Las antraciclinas son, entre los antibióticos, de los más efectivos fármacos anticancerígenos y de más amplio espectro. Se usan en el tratamiento de cáncer de pulmón, ovarios, útero, estómago, vejiga, mama, leucemia y linfomas. Se conoce que afecta la topoisomerasa II por intercalación en el ADN.
La primera antraciclina aislada de una actinobacteria (Streptomyces peucetius) fue la daunorubicina. Posteriormente se sintetizó en el laboratorio la doxorrubicina, y actualmente se usan también la epirubicina, y la idarubicina.
Antraquinonas
Las antraquinonas o antracenedionas son compuestos derivados del antraceno, similares a las antraciclinas, que afectan la actividad de la topoisomerasa II por intercalamiento en el ADN. Son usadas para el cáncer de mama metastásico, el linfoma no hodgkiniano (LNH) y la leucemia.
Estos fármacos fueron encontrados en los pigmentos de algunos insectos, plantas (frángula, sen, ruibarbo), líquenes y hongos; así como en la hoelita, que es un mineral natural. Dependiendo de su dosis, pueden ser cancerígenas.
Entre estos compuestos, tenemos la mitoxantrona y su análogo la losoxantrona. Estos impiden la proliferación de células tumorales malignas, uniéndose al ADN de forma irreversible.
Epidofilotoxinas
Las podofilotoxinas, como las epidofilotoxinas (VP-16) y el tenipósido (VM-26), forman un complejo con la topoisomerasa II. Son usadas contra el cáncer de pulmón, testicular, leucemia, linfomas, cáncer de ovario, carcinoma de mama y tumores intracraneales malignos, entre otros. Se aíslan de las plantas Podophyllum notatum y P. peltatum.
Análogos de camptotecinas
Las campotecinas son compuestos que inhiben la topoisomerasa I, y entre ellas se encuentran la irinotecan, la topotecan y la diflomotecan.
Estos compuestos han sido usados contra el cáncer de colon, de pulmón y de mama, y se obtienen de manera natural de la corteza y de las hojas de la especie arbórea Camptotheca acuminata de las cornáceas chinas y del Tibet.
Inhibición natural
Pueden también ocurrir alteraciones estructurales de las topoisomerasas I y II de manera completamente natural. Esto puede suceder durante algunos eventos que afectan su proceso catalítico.
Entre estas alteraciones, se pueden citar la formación de dímeros de pirimidina, desajustes de bases nitrogenadas y otros eventos causados por el estrés oxidativo.
- Anderson, H., & Roberge, M. (1992). DNA topoisomerase II: A review of its involvement in chromosome structure, DNA replication, transcription and mitosis. Cell Biology International Reports, 16(8):717–724. doi:10.1016/s0309-1651(05)80016-5
- Chhatriwala, H., Jafri, N., & Salgia, R. (2006). A review of topoisomerase inhibition in lung cancer. Cancer Biology & Therapy, 5(12):1600–1607. doi:10.4161/cbt.5.12.3546
- Ho, Y.-P., Au-Yeung, S. C. F., & To, K. K. W. (2003). Platinum-based anticancer agents: Innovative design strategies and biological perspectives. Medicinal Research Reviews, 23(5):633–655. doi:10.1002/med.10038
- Li, T.-K., & Liu, L. F. (2001). Tumor cell death induced by topoisomerase-Targeting drugs. Annual Review of Pharmacology and Toxicology, 41(1):53–77. doi:10.1146/annurev.pharmtox.41.1.53
- Liu, L. F. (1994). DNA Topoisomerases: Topoisomerase-Targeting Drugs. Academic Press. pp 307
- Osheroff, N. and Bjornsti, M. (2001). DNA Topoisomerase. Enzymology and Drugs. Vol. II. Humana Press. pp 329.
- Rothenberg, M. L. (1997). Topoisomerase I inhibitors: Review and update. Annals of Oncology, 8(9), 837–855. doi:10.1023/a:1008270717294
- Ryan B. (2009, december 14). Topoisomerase 1 and 2. [Archivo de video]. Recuperado de youtube.com
