Sulfato de sodio (Na2SO4): estructura, propiedades, usos, obtención
El sulfato de sodio es una sal inorgánica cuya fórmula química es Na2SO4. Consiste de un sólido de color blanco, presente bajo tres formas: anhidro, el heptahidrato (de escasa existencia) y el decahidrato (el cual se conoce como sal de Glaubert); este último es la forma más abundante del sulfato de sodio.
El sulfato de sodio decahidrato, Na2SO4·10H2O, fue descubierto en 1625 por Glaubert en el agua de un manantial, quien la nombró sal mirabilis (sal milagrosa) debido a sus propiedades medicinales.

El sulfato de sodio tiene numerosas aplicaciones en la industria textil y papelera, así como en la fabricación de vidrio. Sus usos se amplían con las aplicaciones térmicas, las cuales incluyen el suministro ambiental de calor y la refrigeración de las computadoras portátiles.
El sulfato de sodio es un compuesto de baja toxicidad y sus acciones dañinas, son fundamentalmente de carácter mecánico y no químico. Por razones cristalográficas esta sal, al igual que su homóloga de potasio, K2SO4, presenta estructuras entramadas y polimórficas.
Índice del artículo
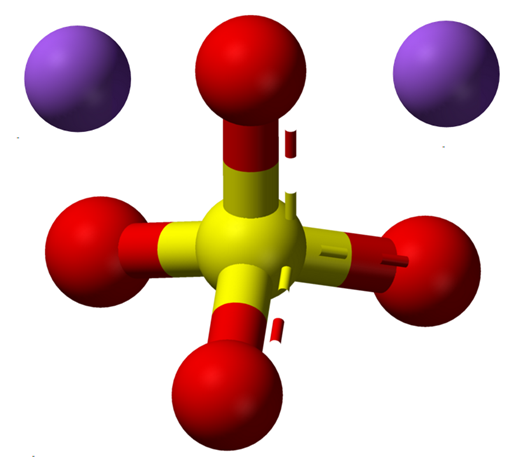
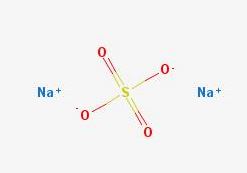
La fórmula Na2SO4 indica de una vez que en los cristales de la sal los iones Na+ y SO42- se hallan en una relación 1:2; es decir, que por cada dos cationes Na+ hay un anión SO42- interaccionando con ellos mediante atracción electrostática (imagen superior).
Por supuesto, esto aplica para el Na2SO4 anhidro, sin moléculas de agua coordinadas con el sodio dentro de los cristales.
A pesar de ser una sal en apariencia simple, su descripción estructuralmente es compleja. El Na2SO4 presenta polimorfismo, teniendo hasta cinco fases cristalinas: I, II, III, IV y V, cuyas temperaturas de transición son 180, 200, 228, 235 y 883 ºC, respectivamente.
Aunque no haya referencias que lo certifiquen, el Na2SO4I debe ser el que posee una estructura cristalina hexagonal, más densa en comparación a la ortorrómbica del Na2SO4III, en cuyos cristales el Na+ forma tetraedros (NaO4) y octaedros (NaO6) de coordinación; es decir, puede estar rodeado de cuatro o seis aniones SO42-.
Mientras, la estructura cristalina monoclínica de su hidrato más importante, Na2SO4·10H2O, es más simple. En ella prácticamente son las moléculas de agua las que interaccionan o se coordinan con el Na+ en los octaedros Na(H2O)6+, con los SO42- apenas aportando estabilidad suficiente al cristal para que exista en fase sólida.
No obstante, su punto de fusión (32,38 ºC) mucho menor al de la sal anhidra (884 ºC) demuestra cómo las moléculas de aguas y sus puentes de hidrógeno debilitan las interacciones iónicas, más fuertes, en el Na2SO4.
-Sulfato de sodio (IUPAC)
-Sal de Glauber (decahidrato)
-Sal milagrosa (decahidrato)
-Sulfato disódico.
142,04 g/mol (anh¡dro)
322,20 g/mol (decahidrato)
Sólido cristalino higroscópico de color blanco
Inodoro
Amargo y salino
2,664 g/cm3 (anhidro)
1,464 g/cm3 (decahidrato)
Nótese cómo las moléculas de agua dentro de los cristales ocasiona que estos se dilaten y, por ende, disminuyan su densidad.
884 ºC (anhidro)
32,38 ºC (decahidrato)
1.429 ºC (anhidro)
4,76 g/100 ml (0 ºC)
13,9 g/100 ml (20 ºC)
42,7 g/100 ml (100 ºC)
Todos valores de solubilidad corresponden a la sal anhidra, la cual es bastante soluble en agua en todas las temperaturas.
La solubilidad aumenta en forma abrupta entre 0 ºC y 38,34 ºC, observándose que en esta gama de temperaturas la solubilidad aumenta más de 10 veces. Sin embargo, a partir de 32,38 ºC la solubilidad es independiente de la temperatura.
Ocurre que a la temperatura 32,8 ºC el sulfato de sodio decahidratado se disuelve en su agua cristalina propia. Se alcanza pues un equilibrio entre la sal decahidrata, la sal anhidra y la solución saturada de sulfato de sodio.
Mientras se mantenga la condición trifásica, la temperatura permanecerá constante, lo cual permite calibrar la temperatura de los termómetros.
Por otro lado, las solubilidades para la sal heptahidratada son:
19,5 g/100 ml (0 ºC)
44,0 g/100 ml (20 ºC)
Nótese que a 20 °C la sal heptahidratada es tres veces más soluble que la anhidra.
1,468 (anhidro)
1,394 (decahidrato)
Estable bajo las condiciones de almacenamiento recomendadas. Incompatible con ácidos y bases fuertes, aluminio y magnesio.
Cuando es calentado a descomposición emite un humo tóxico de óxido sulfuroso y óxido de sodio.
Una disolución acuosa al 5 % tiene un pH de 7.
El sulfato de sodio se disocia en solución acuosa en 2 Na+ y SO42-, lo cual permite que el ion sulfato se combine con el Ba2+ para precipitar el sulfato de bario. Prácticamente ayuda a desplazar los iones de bario de las muestras de agua.
El sulfato de sodio se convierte en sulfuro de sodio mediante la reacción a temperaturas elevadas con el carbón:
Na2SO4 + 2 C => Na2S + 2 CO2
La sal de Glaubert, NaSO4.10H2O reacciona con el carbonato de potasio para producir carbonato de sodio.
El sulfato de sodio se utiliza en la fabricación de pulpa de papel. Se usa en la elaboración de papel Kraft, el cual no contiene lignina ni se le somete al proceso de blanqueamiento, razón que le confiere gran resistencia. Además, se emplea en la fabricación del cartón.
Se usa como material de relleno de detergentes sintéticos para uso en el hogar, agregándose al detergente para reducir la tensión superficial.
Se emplea en la fabricación de vidrio para reducir o eliminar la presencia de burbujas pequeñas de aire en el vidrio fundido. Adicionalmente, elimina la formación de escoria durante el proceso de refinado del vidrio fundido.
El sulfato de sodio se emplea como mordiente, ya que facilita le interacción de los tintes con las fibras de las telas. El sulfato de sodio decahidratado se emplea en la prueba de tinte.
Además, se utiliza el sulfato de sodio como diluyente de tintes y agente auxiliar de la impresión de tintes; tales como tintes directos, tintes de azufre y otros agentes que favorecen la tinción del algodón. También se usa como agente que retarda los tintes directos de la seda.
El sulfato de sodio decahidratado se utiliza como laxante, ya que es poco absorbido en el intestino, y por lo tanto permanece en la luz de este provocando un aumento de volumen. Esto estimula el incremento en las contracciones peristálticas las cuales inducen la expulsión del contenido intestinal.
El sulfato de sodio es un antídoto para controlar las intoxicaciones con sales de bario y de plomo. La sal de Glaubert es eficaz para la eliminación de ciertos medicamentos ingeridos en exceso; por ejemplo, el paracetamol (acetoaminofen).
Además, se emplea para suministrar electrolitos deficientes con presencia en soluciones isoosmóticas.
El sulfato de sodio por ser un reactivo inerte, se emplea para la eliminación de agua de soluciones de compuestos orgánicos.
El sulfato de sodio se utiliza como materia prima para la producción de numerosas sustancias, entre ellas: sulfuro de sodio, carbonato de sodio y sulfato de amonio.
El sulfato de sodio se obtiene por extracción minera y por reacciones químicas.
Hay tres menas o minerales que son explotados con rendimiento comercial: la thenardita (Na2SO4), la mirabilita (Na2SO4·10H2O) y la glaubarita (Na2SO4·CaSO4).
En España, los yacimientos de thenardita y mirabilita son explotados por minería subterránea de galerías y pilares. Mientras, la glauberita se obtiene a cielo abierto, mediante grandes balsas que se colocan sobre el depósito mineral.
El terreno es preparado con voladuras de baja intensidad para producir una porosidad que permita la lixiviación del sulfato de sodio. La fase de producción ocurre con el riego por aspersión con agua dulce de la glauberita, cuya lixiviación se propaga en forma descendente.
Se recolecta la salmuera del sulfato de sodio, quedando como relleno el residuo de sulfato de calcio.
El sulfato de sodio se obtiene durante la producción de ácido clorhídrico mediante dos procesos: el proceso de Mannheim y el proceso de Hardgreaves.
Proceso de Mannheim
Se realiza en hornos grandes de acero y con una plataforma de reacción de acero de 6 m. La reacción ocurre entre el cloruro de sodio y el ácido sulfúrico:
2 NaCl + H2SO4 => 2 HCl + Na2SO4
Proceso de Hardgreaves
Involucra la reacción del cloruro de sodio, óxido de azufre, oxigeno y agua:
4 NaCl + 2 SO2 + O2 + 2 H2O => 4 HCl + Na2SO4
Otros
El sulfato de sodio se produce en la reacción de neutralización entre el hidróxido de sodio y el ácido sulfúrico:
2 NaOH + H2SO4 => Na2SO4 + H2O
El sulfato de sodio es un subproducto de la producción de numerosos compuestos. Se extrae de los residuos líquidos descargados durante la producción de la viscosa y el celofán. También en la producción de dicromato de sodio, fenoles, ácido bórico y carbamato de litio.
El sulfato de sodio es considerado un compuesto de baja toxicidad. Sin embargo, puede producir algunos daños en la persona que lo utiliza en forma inadecuada.
Por ejemplo, puede ocasionar por contacto irritación ocular, enrojecimiento y dolor. En la piel puede provocar irritación y alergia en algunas personas. Su ingestión puede ocasionar irritación del tracto digestivo con náuseas, vómitos y diarrea. Y finalmente, su inhalación produce irritación en el tracto respiratorio.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2019). Sodium sulfate. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2019). Sodium sulfate. PubChem Database. CID=24436. Recuperado de: pubchem.ncbi.nlm.nih.gov
- B. N. Mehrotra. (1978). The crystal structure of Na2SO4III. Recuperado de: rruff-2.geo.arizona.edu
- Glauberita-Thenardita (sulfato sódico). [PDF]. Recuperado de: igme.es
