Disulfuro de carbono (CS2): estructura, propiedades, usos, riesgos
El disulfuro de carbono es un compuesto formado por la unión de un átomo de carbono (C) y dos átomos de azufre (S). Su fórmula química es CS2. Es un líquido incoloro o ligeramente amarillo con olor desagradable por las impurezas que contiene (compuestos azufrados). Cuando es puro su olor es suave y dulce, semejante al del cloroformo o al del éter.
Se origina de forma natural por la acción de la luz del sol sobre moléculas orgánicas que se encuentran en el agua del mar. Además, se produce en aguas de pantano y también es expulsado de los volcanes junto con otros gases.
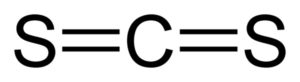
El disulfuro de carbono es un líquido volátil y además es muy inflamable, por lo que debe mantenerse alejado de llamas y chispas o aparatos que puedan producirlas, incluso bombillos eléctricos.
Tiene la capacidad de disolver un gran número de compuestos, materiales y elementos, como fósforo, azufre, selenio, resinas, lacas, etc. Por lo tanto encuentra utilidad como solvente.
Además es intermediario en diversas reacciones químicas industriales, como por ejemplo la producción del rayón o seda artificial.
Debe manipularse con precaución y con implementos de protección pues es muy tóxico y peligroso.
Índice del artículo
El disulfuro de carbono posee un átomo de carbono y dos átomos de azufre a los lados de este.
Los enlaces entre el átomo de carbono y los átomos de azufre son covalentes y dobles, por lo tanto son muy fuertes. La molécula de CS2 posee una estructura lineal y simétrica.

– Disulfuro de carbono
– Bisulfuro de carbono
– Anhídrido ditiocarbónico
Líquido de incoloro a amarillento.
76,15 g/mol
-110,8 °C
46,0 ºC
-30 ºC (método de copa cerrada).
90 °C
Líquido = 1,26 g/cm3 a 20 ºC.
Vapor = 2,67 veces la del aire.
Sus vapores son más del doble de pesados que el aire y el líquido es más pesado que el agua.
279 mmHg a 25 °C.
Esta es una presión de vapor alta.
Muy poco soluble en agua: 2,16 g/L a 25 °C. Soluble en cloroformo. Miscible con etanol, metanol, éter, benceno, cloroformo y tetracloruro de carbono.
El CS2 se evapora fácilmente a temperatura ambiente pues su punto de ebullición es muy bajo y su presión de vapor es muy alta.
El disulfuro de carbono es extremadamente inflamable. Sus vapores se inflaman con mucha facilidad, incluso con el calor de un bombillo de luz eléctrica. Esto significa que reacciona con el oxígeno muy rápidamente:
CS2 + 3 O2 → CO2 + 2 SO2
El hecho de que tenga una elevada presión de vapor a temperatura ambiente hace que sea peligroso al estar cerca de una llama.
Cuando se calienta hasta la descomposición puede explotar fácilmente, emitiendo gases tóxicos de óxidos de azufre. Por encima de 90 °C se enciende espontáneamente.
Se descompone al permanecer almacenado por largo tiempo. Ataca el cobre y sus aleaciones. También reacciona con algunos plásticos, gomas y recubrimientos.
Reacciona bajo ciertas condiciones con agua, formando sulfuro de carbonilo OCS, dióxido de carbono CO2 y disulfuro de hidrógeno H2S:
CS2 + H2O → OCS + H2S
CS2 + 2 H2O → CO2 + 2 H2S
Con alcoholes (ROH) en medio alcalino forma xantatos (RO-CS-SNa):
CS2 + ROH + NaOH → H2O + RO–C(=S)–SNa
El disulfuro de carbono se prepara comercialmente mediante la reacción de azufre con carbón. El proceso se realiza a temperaturas de 750-900 °C.
C + 2 S → CS2
En lugar de carbón también se puede utilizar metano o gas natural, e incluso se han utilizado etano, propano y propileno, en cuyo caso la reacción ocurre a 400-700 °C con un alto rendimiento.
También se puede preparar haciendo reaccionar el gas natural con sulfuro de hidrógeno H2S a muy alta temperatura.
El CS2 es un producto natural presente en la atmósfera en cantidades muy pequeñas (trazas). Se produce fotoquímicamente en aguas superficiales.
La acción de la luz del sol sobre ciertos compuestos presentes en el agua de mar como la cisteína (un aminoácido) conduce a la formación de disulfuro de carbono.

También es liberado de forma natural durante las erupciones volcánicas y se encuentra en pequeñas cantidades sobre los pantanos.
Normalmente estamos expuestos a respirarlo en muy pequeñas proporciones y está presente en algunos alimentos. Además se encuentra en el humo de los cigarrillos.
En el ambiente se descompone por la luz del sol. En el suelo se mueve a través de él. Algunos microorganismos del suelo lo descomponen.
El disulfuro de carbono es un compuesto químico importante pues sirve para preparar otras sustancias químicas. Puede actuar como intermediario químico.
También se usa como solvente de proceso por ejemplo para disolver fósforo, azufre, selenio, bromo, yodo, grasas, resinas, ceras, lacas y gomas.
Permite la manufactura de productos farmacéuticos y herbicidas, entre otros.
Con el CS2 se preparan xantatos que son compuestos utilizados en la manufactura de rayón y celofán.
Para obtener seda artificial o rayón se parte de celulosa la cual se trata con álcali y disulfuro de carbono CS2 y se transforma en xantato de celulosa, soluble en álcali. Esta solución es viscosa y por ello se denomina “viscosa”.
La viscosa se hace pasar a presión por orificios muy pequeños dentro de un baño ácido. Aquí el xantato de celulosa se transforma de nuevo en celulosa la cual es insoluble y se forman hilos largos y brillantes.
Los hilos o filamentos se pueden hilar para dar un material conocido como rayón.
(1) Celulosa + NaOH → Álcali-celulosa
ROH + NaOH → RONa
(2) Álcali-celulosa + Disulfuro de carbono → Xantato de celulosa
RONa + S=C=S → RO–C(=S)–SNa
(3) Xantato de celulosa + Ácido → Celulosa (filamentos)
RO–C(=S)–SNa + Ácido → ROH

Si se precipita la celulosa haciendo pasar el xantato por una ranura estrecha, se regenera la celulosa en forma de láminas delgadas que conforman el celofán. Este se suaviza con glicerol y se emplea como película protectora de objetos.

El disulfuro de carbono reacciona con el cloro Cl2 para dar tetracloruro de carbono CCl4, el cual es un importante solvente que no es combustible.
CS2 + 3 Cl2 → CCl4 + S2Cl2
El disulfuro de carbono participa en la vulcanización en frío de las gomas, sirve como intermediario en la fabricación de pesticidas, se emplea para generar catalizadores en la industria petrolera y en la manufactura de papel.
Los xantatos preparados con CS2 se utilizan en la flotación de minerales.
El CS2 es un veneno para los organismos vivos. Antiguamente se utilizaba para destruir plagas como ratas, marmotas y hormigas, vertiendo el líquido en todo espacio cerrado en el cual habitaban estos animales (madrigueras y hormigueros).
Al ser utilizado para dicho fin los densos vapores tóxicos acababan con todo organismo vivo que se encontrase en el espacio confinado.
También se utilizó como antihelmíntico para animales y para eliminar larvas de moscardones del estómago de caballos.
En agricultura se empleaba como insecticida y nematicida, para fumigar el suelo, para fumigación de viveros, graneros, silos y molinos de cereales. También se fumigaban vagones de ferrocarril, buques y barcazas.

Todos estos usos fueron prohibidos debido a la alta inflamabilidad y toxicidad del CS2.
El CS2 es altamente inflamable. Muchas de sus reacciones pueden causar fuego o explosión. Las mezclas de sus vapores con aire son explosivas. Al inflamarse produce gases irritantes o tóxicos.
No debe verterse el disulfuro de carbono por los desagües, pues en los tubos queda una mezcla de CS2 y aire que puede originar una explosión si es encendida por accidente.
Sus vapores se incendian espontáneamente en contacto con chispas o con superficies calientes.
El disulfuro de carbono irrita severamente ojos, piel y mucosas.
Si se inhala o se ingiere afecta gravemente el sistema nervioso central, el sistema cardiovascular, ojos, riñones e hígado. También se puede absorber a través de la piel causando daño.
- U.S. National Library of Medicine. (2020). Carbon disulfide. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Mopper, K. and Kieber, D.J. (2002). Photochemistry and the Cycling of Carbon, Sulfur, Nitrogen and Phosphorus. In Biogeochemistry of Marine Dissolved Organic Matter. Recuperado de sciencedirect.com.
- Meyer, B. (1977). Industrial Uses of Sulfur and Its Compounds. Carbon Disulfide. In Sulfur, Energy, and Environment. Recuperado de sciencedirect.com.
- Pohanish, R.P. (2012). C. Carbon disulfide. In Sittig’s Handbook of Toxic and Hazardous Chemicals and Carcinogens (Sixth Edition). Recuperado de sciencedirect.com.
- Morrison, R.T. and Boyd, R.N. (2002). Organic Chemistry. 6th Edition. Prentice-Hall.
- Windholz, M. et al. (editors) (1983). The Merck Index. An Encyclopedia of Chemicals, Drugs, and Biologicals. Tenth Edition. Merck & CO., Inc.
