Principio de Le Châtelier: concepto, aplicaciones, ejemplos
¿Qué es el principio de Le Châtelier?
El principio de Le Châtelier es una regla general que permite predecir el efecto que tienen los distintos factores que afectan el equilibrio químico. En particular, ayuda a predecir en qué dirección se desplazará una reacción que se encuentra en equilibrio cuando dicho equilibrio es perturbado por un agente externo.
Este principio establece que:
“Cuando un sistema que se encuentra en equilibrio es sometido a una perturbación o a una tensión externa, el sistema reacciona en la dirección que le permita contrarrestar parcialmente dicha perturbación”.
Por perturbación se entiende bien sea:
- Un cambio en la concentración de alguno de los reactivos.
- Un cambio en la concentración de alguno de los productos.
- Cambios en la presión.
- Cambios en el volumen.
- Un cambio en la temperatura
Cuando ocurren cambios como los mencionados, una de las dos reacciones, la directa o la inversa, se ve favorecida con respecto a la otra, por lo que el sistema reacciona en dicho sentido desplazándose hacia un nuevo estado de equilibrio.
Esto es similar a los ajustes que hace un equilibrista sobre la cuerda floja. Cuando la gravedad le hala de un lado, el equilibrista reacciona desplazándose hacia el lado contrario. Decimos que su equilibrio se desplazó, ya que aún sigue en equilibrio (no se cae), pero ahora tiene una postura diferente.
A continuación, veremos cómo se emplea el principio de Le Châtelier para predecir la dirección en la que un sistema reaccionará al sufrir diferentes tipos de tensiones o perturbaciones tales como: cambios en la concentración, en el volumen, en la presión y en la temperatura.
Efecto de cambios en la concentración
Supongamos que tenemos la siguiente reacción en equilibrio:
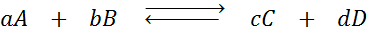
Si a esta reacción le cambiamos la concentración de alguna de las especies involucradas (A, B, C o D), el principio de Le Châtelier predice que el sistema reaccionará para contrarrestar este cambio bien sea consumiendo el exceso añadido o reponiendo la cantidad eliminada. Se pueden dar 4 situaciones diferentes:
1. Aumento de la concentración de los reactivos
Si aumentamos la concentración de un reactivo, por ejemplo, A, según el principio de Le Châtelier, el sistema reaccionará para consumir el exceso añadido. Esto significa que reaccionará en sentido directo (de izquierda a derecha), ya que en esta dirección se consume A.
En este caso se dice que se favorece la reacción directa y que el equilibrio se desplazó hacia los productos, ya que en el nuevo equilibrio la concentración de productos es mayor que la que había en el equilibrio original.
2. Aumento de la concentración de los productos
Si aumentamos la concentración de un producto, por ejemplo, C, el sistema reaccionará en sentido inverso para consumir el exceso de C añadido (es decir, de derecha a izquierda).
En este caso se dice que se favorece la reacción inversa y que el equilibrio se desplaza hacia los reactivos.
3. Disminución de la concentración de los reactivos
La disminución de la concentración tiene el efecto opuesto al aumento de dicha concentración. Si retiramos A del medio, disminuyendo así su concentración, el sistema reaccionará hacia la izquierda (en sentido inverso) para contrarrestar el cambio. El equilibrio se desplaza hacia los reactivos.
4. Disminución de la concentración de los productos
Si disminuimos la concentración de C o D, el sistema reaccionará en sentido directo para reponer la concentración disminuida (es decir, de izquierda a derecha). El equilibrio se desplaza hacia los productos.
Ejemplo:
Determinar el efecto de añadir más iones tiocianato (SCN–) en el siguiente equilibrio químico, sabiendo que el producto de la derecha es rojo intenso y el hierro (III) es de color amarillo.
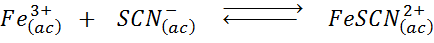
Solución: En este caso, estamos añadiendo tiocianato que es un reactivo, por lo que el equilibrio se debe desplazar hacia la derecha, aumentando la concentración del complejo y, por lo tanto, la intensidad del color rojo en la solución.
Efecto de cambios en el volumen y la presión
Los cambios en el volumen y la presión no afectan considerablemente a las reacciones en equilibrio en estado líquido o sólido, pero sí pueden afectar a las que se encuentran en estado gaseoso. Esto se debe a que, para los gases, la concentración es proporcional a la presión, como lo predice la ley de los gases ideales.
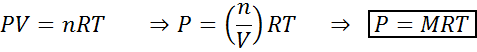
Aumentar la presión de un gas manteniendo la temperatura constante es equivalente a disminuir su volumen, por lo que el efecto de ambas perturbaciones será el mismo.
Si a una reacción en equilibrio que involucra gases le aumentamos la presión total (o le disminuimos su volumen), el sistema reaccionará tratando de reducir nuevamente dicha presión, por lo que el equilibrio se desplazará hacia donde haya una menor cantidad de moléculas de partículas gaseosas.
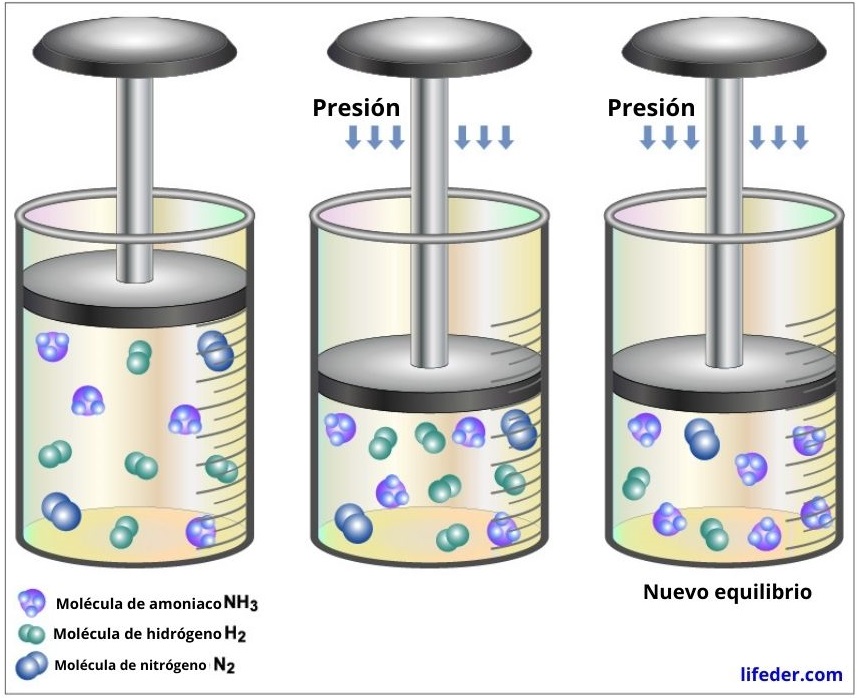
Si en la reacción se consumen y se producen el mismo número de moléculas gaseosas, entonces los cambios de volumen y presión no afectarán al equilibrio.
Por otro lado, si solo modificamos la presión parcial de alguno de los gases, el efecto es el mismo que el de aumentar o disminuir la concentración de dicha especie.
Ejemplo:
Dada la reacción de descomposición del tetróxido de dinitrógeno en equilibrio:
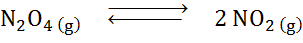
Determine el efecto de reducir el volumen, aumentando la presión.
Solución: Si aumentamos la presión total del sistema o reducimos su volumen, el equilibrio se desplaza hacia los reactivos, ya que, en dicha dirección, hay una disminución neta de moléculas gaseosas (se consumen 2 y se produce 1) lo que permite contrarrestar el aumento de presión.
Efecto de cambios en la temperatura
El efecto de la temperatura sobre el equilibrio químico es diferente al de los demás factores que hemos visto hasta ahora. En los casos anteriores, se obtiene un nuevo equilibrio luego de la perturbación, pero se mantiene la misma constante de equilibrio. Sin embargo, si cambia la temperatura, cambiará la constante de equilibrio.
Para saber cómo cambia la constante de equilibrio con la temperatura, se necesita conocer el signo de la entalpía de reacción:
- Si una reacción libera calor, es decir, es exotérmica, su entalpía es negativa, y la constante de equilibrio disminuye al aumentar la temperatura. En estos casos, el equilibrio se desplaza en sentido inverso hacia los reactivos.
- Si una reacción absorbe calor, es decir es endotérmica, su entalpía es positiva y ocurre justo lo contrario.
Recordar el efecto de la temperatura es fácil si consideramos al calor como un reactivo que se produce en el caso de las reacciones exotérmicas y se consume en el caso de las endotérmicas. Aumentar la temperatura sería como “agregar” calor al sistema y enfriarlos sería equivalente a retirarlo.
Entonces, si una reacción es exotérmica y se aumenta la temperatura, sería como añadir un producto de la reacción, por lo que el equilibrio se desplaza en dirección contraria, hacia los reactivos, y si se enfría pasa lo contrario.
Por otro lado, si una reacción es endotérmica y se aumenta la temperatura, sería como añadir un reactivo, por lo que el equilibrio se desplaza hacia los productos, mientras que una disminución de la temperatura tiene el efecto contrario.
Ejemplo:
La reacción de descomposición del N2O4 tiene una entalpía de reacción de +58,0 kJ/mol. ¿En qué dirección se desplazará el equilibrio si se disminuye la temperatura?
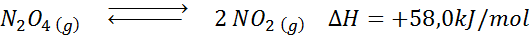
Solución: Como la entalpía es positiva, la reacción es endotérmica. Por esta razón, enfriarla favorecerá la reacción inversa, y el equilibrio se desplazará hacia los reactivos, es decir, hacia la formación de más N2O4.
Efecto de catalizadores, inhibidores y sustancias inertes
Los catalizadores e inhibidores afectan la velocidad con la que ocurren las reacciones, pero afectan en igual medida tanto a la reacción directa como a la indirecta. Por esta razón, no afectan el estado de equilibrio.
Por otro lado, la adición de una sustancia inerte como un gas que no reacciona con ninguno de los reactivos o productos, no afectará de ninguna manera ni a la reacción directa ni a la inversa, por lo que tampoco tendrá efecto alguno sobre el equilibrio.
Aplicación del Principio de Le Châtelier
Comprender bien este principio es muy útil, ya que nos permite manipular el estado de equilibrio de una reacción a nuestra conveniencia.
En aquellos casos en los que nos interesa obtener más producto de una reacción para mejorar el rendimiento, utilizamos todas las herramientas posibles para favorecer la reacción directa y desplazar el equilibrio hacia los productos.
Esto significa:
- Añadir grandes cantidades de reactivos, si estos son económicos.
- Retirar producto a medida que progresa la reacción, para así mantener el sistema en constante estado de tensión, siempre tratando de alcanzar el equilibrio reaccionando en sentido directo.
- Aumentar la temperatura en el caso de las reacciones endotérmicas.
- Aumentar la presión en aquellas reacciones en las que se consumen más moléculas de gases de las que se producen.
También puede que queramos minimizar la cantidad de un producto que se forma por una reacción no deseada. En estos casos hacemos lo contrario.
Ejemplo de aplicación del Principio de Le Châtelier
En la síntesis orgánica se emplea el principio de Le Châtelier constantemente para mejorar los rendimientos de las reacciones.
Por ejemplo, en las reacciones de deshidratación de alcoholes, se añaden desecantes al medio que absorben el agua formada durante la reacción. Esto reduce la concentración de dicho producto, lo cual desplaza el equilibrio hacia los productos.
