Bromuro de hidrógeno: qué es, propiedades, síntesis, usos
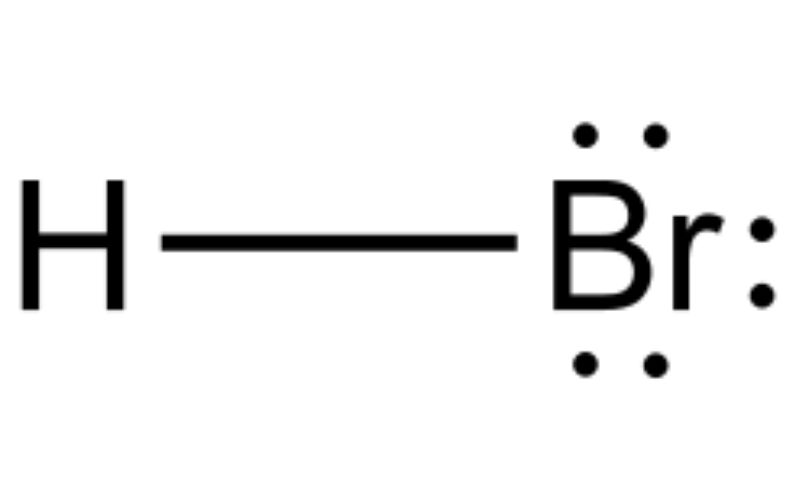
El bromuro de hidrógeno es una molécula diatómica con un enlace covalente. El compuesto se clasifica como un haluro de hidrógeno, siendo un gas incoloro que al disolverse en agua forma ácido bromhídrico.
Propiedades físicas y químicas
– El bromuro de hidrógeno es un gas incoloro a temperatura ambiente, con un olor agrio e irritante. El compuesto es estable, pero se oscurece poco a poco cuando se expone al aire o a la luz.
– Posee un peso molecular de 80.91 g/mol y una densidad de 3,307 g/L, lo que lo hace más pesado que el aire. El gas se condensa produciendo un líquido incoloro de punto de ebullición de -66,73° C.
– Al seguir enfriando, el líquido se solidifica, obteniéndose cristales de color blanco, cuyo punto de fusión es de -86,82° C, con una densidad de 2,603 g/ml.
– El bromuro de hidrógeno es más soluble en agua que el cloruro de hidrógeno, pudiendo disolverse 221 g en 100 ml de agua a 0° C, lo que equivale a un volumen de 612 litros de este gas por cada litro de agua. También es soluble en alcohol y otros solventes orgánicos.
– En solución acuosa (ácido bromhídrico) las propiedades ácidas del HBr son dominantes (como es el caso del HF y el HCl) y, en el enlace entre el hidrógeno y el halógeno, es más débil en el caso del bromuro de hidrógeno que en el cloruro de hidrógeno.
Por lo tanto, si se hace pasar cloro a través del bromuro de hidrógeno, se observa la formación de vapores de color marrón característicos del bromo molecular. La reacción que lo explica es la siguiente:
2HBr + Cl2 → 2HCl + Br2
Esto es indicativo de que el bromuro de hidrógeno es un agente reductor más fuerte que el cloruro de hidrógeno y que el cloruro de hidrógeno es un mejor agente oxidante.
– El bromuro de hidrógeno es un ácido fuerte anhidro (sin agua). Reacciona rápida y exotérmicamente con bases de todo tipo (incluyendo aminas y amidas).
– Reacciona exotérmicamente con carbonatos (incluyendo piedra caliza y materiales de construcción que la contienen) y carbonatos de hidrógeno para generar dióxido de carbono.
– Reacciona con sulfuros, carburos, boruros y fosfuros para generar gases tóxicos o inflamables.
– Reacciona con muchos metales (incluyendo aluminio, zinc, calcio, magnesio, hierro, estaño y todos los metales alcalinos) para generar gas de hidrógeno inflamable.
Reactividad y peligros
El bromuro de hidrógeno es un compuesto corrosivo e irritante. Es extremadamente peligroso en caso de contacto con la piel (irritante y corrosivo) y los ojos (irritante) y en los casos de ingestión y de inhalación (irritante pulmonar).
El compuesto se guarda en contenedores presurizados de gas licuado. La exposición prolongada al fuego o al calor intenso puede resultar en la violenta ruptura del contenedor presurizado, el cual puede salir disparado liberando vapores tóxicos irritantes.
La exposición prolongada a concentraciones bajas o la exposición a corto plazo a altas concentraciones puede resultar en efectos adversos a la salud debido a su inhalación.
La descomposición térmica del bromuro de hidrógeno anhidro produce gases tóxicos de bromo. Puede llegar a ser inflamable si reacciona liberando hidrógeno. En contacto con cianuro, produce gases tóxicos de cianuro de hidrógeno.
Si este producto químico en solución entra en contacto con los ojos, deben lavarse inmediatamente con grandes cantidades de agua, levantando ocasionalmente los párpados inferior y superior.
No se deben usar lentes de contacto cuando se trabaja con este producto químico. Si el tejido ocular está congelado, se debe buscar atención médica inmediata.
Si el tejido no está congelado, enjuague los ojos de inmediato y completamente con grandes cantidades de agua durante al menos 15 minutos, levantando ocasionalmente los párpados inferior y superior.
Si este producto químico en solución entra en contacto con la piel y no produce una congelación, enjuague inmediatamente la piel contaminada con agua. Si penetra en la ropa, retírela inmediatamente y lave la piel con agua.
Si se produce congelación, busque atención médica inmediatamente. No se debe frotar las áreas afectadas o enjuagar con agua. Con el fin de prevenir más daños en los tejidos, no se debe intentar quitar la ropa congelada de las áreas con escarcha.
Si se inhala grandes cantidades de este producto químico, se debe mover a la persona expuesta al aire fresco inmediatamente. Si la respiración se ha detenido, realice la resucitación boca a boca. Se debe mantener a la víctima caliente y en reposo, además de intentar obtener atención médica lo antes posible.
Síntesis
El bromuro de hidrógeno gaseoso puede fabricarse en el laboratorio mediante la bromación de tetralina (1, 2, 3, 4-tetrahidronaftaleno). La desventaja es que la mitad del bromo se pierde. El rendimiento es aproximadamente del 94%, o lo que es lo mismo, un 47% del bromo termina como HBr.
C10H12 + 4 Br2 → C10H8Br4 + 4 HBr
El gas de bromuro de hidrógeno también se puede sintetizar en el laboratorio mediante la reacción de ácido sulfúrico concentrado sobre bromuro de sodio.
NaBr(s) + H2SO4 → HBr(g) + NaHSO4
La desventaja de este método es que gran parte del producto se pierde por oxidación con exceso de ácido sulfúrico para formar bromo y dióxido de azufre.
2 HBr + H2SO4 → Br2 + SO2 + 2 H2O
El bromuro de hidrógeno se puede preparar en el laboratorio mediante la reacción entre gas hidrógeno purificado y bromo. Esta es catalizada por amianto platinado y se lleva a cabo en un tubo de cuarzo a 250° C.
Br2 + H2[Pt] → 2 HBr
También se puede producir bromuro de hidrógeno anhidro a pequeña escala por termólisis de bromuro de trifenilfosfonio en xileno a reflujo.
Se puede obtener HBr mediante el método del fósforo rojo. En primer lugar, el fósforo rojo se añade en el reactor de agua y posteriormente, de manera lenta, el bromo bajo agitación y la reacción de ácido bromhídrico y ácido fosforoso, por sedimentación, filtración y la destilación obtenida será ácido bromhídrico.
P4+6 Br2+12 H₂O→12 HBr + 4 H3PO3
El bromuro de hidrógeno preparado por los métodos anteriores puede contaminarse con Br2, que puede eliminarse pasando el gas a través de una solución de fenol en tetraclorometano u otro disolvente adecuado a temperatura ambiente, produciendo 2, 4, 6-tribromofenol y con ello generándose más HBr.
Este proceso también se puede llevar a cabo a través de virutas de cobre o gasa de cobre a alta temperatura.
Usos
– El HBr se utiliza en la fabricación de bromuros orgánicos, como bromuro de metilo, bromoetano, etc., e inorgánicos, como bromuro de sodio, bromuro de potasio, bromuro de litio y bromuro de calcio, etc.
– También se emplea en aplicaciones fotográficas y farmacéuticas o para la síntesis de sedantes y anestésicos.
– Se aplica en el secado industrial, acabado textil, agentes de revestimiento, agentes de tratamiento superficial y de ignifugación.
– También se usa para grabar láminas de polisilicio, para la fabricación de chips de ordenador.
– Es un buen disolvente para algunos minerales metálicos, utilizados en el refinamiento de metales de alta pureza.
– En la industria del petróleo, se utiliza como separación de compuestos alcoxi y fenoxi, y un catalizador para la oxidación de hidrocarburos cíclicos e hidrocarburos en cadena a cetonas, ácido o peróxido.
– También se utiliza en tintes sintéticos y especias.
– El compuesto es usado como reactivo analítico en la determinación de azufre, selenio, bismuto, zinc y hierro, para la separación del estaño del arsénico y del antimonio. Es un catalizador de alquilación y agente reductor usado en la síntesis orgánica.
– Se puede usar para la producción de ácido bromhídrico.
– HBr es altamente reactivo y corrosivo para la mayoría de los metales. El ácido es un reactivo común en la química orgánica, usado para la oxidación y la catálisis.
Referencias
- Hydrogen bromide. Tomado de ChemicalBook.
- Material Safety Data Sheet Hydrogen bromide. Tomado de sciencelab.com.
