Tioles: propiedades, síntesis, usos, ejemplos, nomenclatura
Los tioles son compuestos orgánicos que presentan un grupo SH, denominado grupo tiol o sulfihidrilo. Su fórmula general es RSH, pudiendo representar R a un alquilo, un arilo u otro grupo químico. La característica distintiva de los tioles es su fuerte olor apestoso.
Algunos tioles son usados para impartir su olor a los gases combustibles, con el fin de la detección de una fuga de estos gases, que dado su característica pueden ser de gran peligro. Los tioles tienen semejanza con los alcoholes, ya que estos poseen un grupo OH, mientras los tioles un grupo SH.
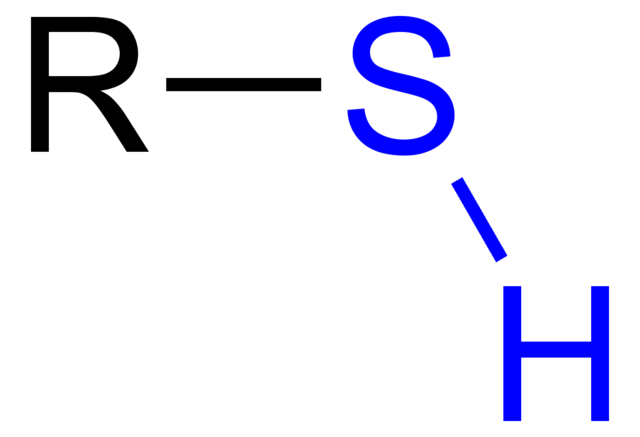
No obstante, poseen a su vez varias diferencias: el grupo OH es más polar que el grupo SH, además que el azufre es un átomo de menor tamaño que el oxígeno y menos electronegativo.
Esto determina que las moléculas de los tioles no formen enlaces de hidrógeno ni con el agua ni entre ellas. Por lo tanto, la solubilidad de los tioles en el agua es baja y su punto de ebullición es más bajo que el de los alcoholes con una cadena de carbonos semejante.
Los tioles son especialmente útiles y frecuentes en sistemas bioquímicos, debido a que varias corresponden a biomoléculas, tal como la coenzima A. Su enlace S-H es más ácido que el O-H, más fácil de romper, y también más fácil de reemplazar o sustituir por otros fragmentos moleculares en numerosas síntesis orgánicas sulfuradas.
Índice del artículo

El grupo OH de los alcoholes y el grupo SH de los tioles comparten un conjunto de propiedades físicas y químicas por pertenecer el oxígeno y el azufre al mismo grupo químico de la Tabla Periódica (grupo VIA).
Loa tioles forman tioéteres, tioacetales y tioésteres, los cuales son análogos a compuestos químicos formados por los alcoholes, tales como éteres, acetales y ésteres. Sin embargo, los enlaces S-H y O-H presentan algunas diferencias que se van a reflejar en las propiedades de los tioles y los alcoholes.
Una característica de los tioles de bajo peso molecular es su olor desagradable, semejante al ajo y a la cebolla. Este olor es de tal magnitud que el olfato humano tiene un umbral de una parte del tiol por diez mil millones de partes de aire.
El etanotiol se agrega al gas natural como medida de seguridad, para detectar así cualquier fuga inflamable pero inodora en sí misma. El olor de los tioles disminuye al aumentar el número de carbonos de su cadena, debido a que disminuye la volatilidad y la proporción de azufre del tiol.
El enlace S-H de los tioles tiene un momento dipolar menor que el enlace O-H de los alcoholes. Además, el átomo de azufre es de menor tamaño y menor electronegatividad que el átomo de oxígeno.
Esto determina que las moléculas de los tioles no puedan formar puentes de hidrógeno ni con el agua ni entre ellas, provocando una diferencia entre las propiedades físicas de los tioles y los alcoholes. Por ejemplo: el metanotiol (CH3SH) tiene un punto de ebullición de 6 ºC, mientras que el metanol (CH3OH) hierve a 65 ºC.
Por lo tanto, a temperatura ambiente (25 ºC) el metanol es un líquido y el metanotiol es un gas.
En resumen: los tioles tienen un punto de ebullición menor que el que presentan los alcoholes correspondientes. Por las mismas razones, la solubilidad de los tioles en el agua y en otros solventes polares es muy baja. Mientras, lo alcoholes de bajo peso molecular son muy solubles en el agua.
El enlace S-H es más débil que el enlace O-H, por lo que enlace S-H se disocia más fácilmente, haciendo que los tioles sean ácidos más fuertes que los alcoholes. La mayoría de los alcoholes tienen un pKa comprendido entre 16 y 18, mientras que los tioles tienen un pKa alrededor de 11.
Esto permite que los tioles sean disueltos fácilmente por el hidróxido de sodio para ser convertidos en su base conjugada tiolato (RS–): un agente nucleofílico muy fuerte.
El grupo SH puede oxidarse para formar enlaces disulfuros (-S-S-) que están presentes en la oxidación del glutatión: un tiol presente en las células y que tiene una función antioxidante.
El bromo u otros halógenos, así como el oxígeno, pueden actuar sobre un tiol para formar puentes disulfuros:
2 RSH + Br → R-S-S-R’ + 2 HBr
Los compuestos RSSR’ son conocidos como sulfuros orgánicos y alquiltioles, R2S.
Por otro lado, los agentes oxidantes fuertes, como el hipoclorito de sodio y el peróxido de hidrógeno, pueden actuar sobre los tioles para originar ácidos sulfónicos:
RSH + H2O2 → RSO3H + 3 H2O
La nomenclatura IUPAC para los tioles es muy parecida a la de los alcoholes: el nombre del alcano del que deriva se le adiciona el sufijo ‘tiol’.
Así por ejemplo, el tiol derivado del butano se llama 1-butanotiol, CH3CH2CH2CH2SH, indicándose con el número la posición del grupo SH en los carbonos de la cadena.
De igual modo existe otra nomenclatura, nuevamente, similar a la de los alcoholes: se sustituye la palabra ‘alcohol’ por ‘mercaptano’ en los nombres de los alcoholes. Por ejemplo, el CH3SH, análogo al alcohol metílico, CH3OH, se llama mercaptano metílico o metil mercaptano.
Otro ejemplo vendría a ser el CH3CH2CH(SH)CH3, llamado 2-butanotiol, mercaptano secbutílico, o secbutil mercaptano. Es decir, se hace hincapié en la identidad de R en la fórmula RSH. De aquí a que las demás normas de nomenclatura para los alcoholes se cumplan también para los tioles.
Y finalmente, cuando el grupo SH está presente en una estructura mayor o donde predominan grupos más importantes, se utiliza el prefijo sulfihidrilo o mercapto.
Por ejemplo, el compuesto CH3CH2CH(SH)COCH3 se llama 3-mercapto-2-pentanona. Nótese que el SH tiene menos prioridad que los grupos oxigenados (a excepción del éter), por lo que le corresponden usualmente numerales menores.
Un método de síntesis de los tioles consisten en la reacción de la tiourea con un haluro de alquilo, lo cual produce una sal intermedia de isotiouronio. Esta es hidrolizada por el hidróxido sodio para la obtención del tiol y urea.
El CH3SH se prepara industrialmente mediante la reacción de sulfuro de hidrógeno con metanol, en presencia de catalizadores ácidos:
CH3OH + H2S → CH3SH + H2O
En otro método de producción, se hace reaccionar un haluro de alquilo con el hidrosulfuro de sodio:
RX + NaSH → RSH + NaX
Los tioles se usan como puentes para unir complejos nanoparticula-enzima a electrodos de oro. Por ejemplo, los tioles son empleados para la fijación del complejo nanopartícula-uricasa, una enzima que interviene en la conversión del ácido úrico en alantoína.
Es una reacción orgánica entre un tiol y un alqueno, denominándose una reacción “click”; que entre otras características, es una reacción de alto rendimiento, amplio alcance, que crea subproductos eliminables por métodos no cromatográficos, y que resulta además fácil de realizar.
La reacción tiol-eno tiene aplicaciones en la síntesis de tioazúcar: azúcar presente en el salicinol, un inhibidor de α-glucosidasas. El salicinol ha sido aislado de plantas usadas en Sri Lanka y la India en el tratamiento de la diabetes.
Además, la reacción tiol-eno se usa en la química de los carbohidratos, las polimerizaciones, química de superficie, química de síntesis y química de los péptidos.

Los tioles alifáticos de bajo peso molecular se incorporan a los gases naturales con el fin de que su fuerte olor sirva de advertencia ante un escape o fuga de gas.
La penicilamina (C5H11NO2S) es un fármaco que se usa en el tratamiento de la enfermedad de Wilson y de la artritis reumatoide.
Y el captopril (C9H15NO3S), por otro lado, se usa en el tratamiento de la hipertensión arterial y en la enfermedad cardíaca congestiva.
Ambos son ejemplos de tioles con aplicaciones medicinales.
Los grupos tioles están presentes, entre otros compuestos con función biológica, en la cisteína, la coenzima A y el glutatión.
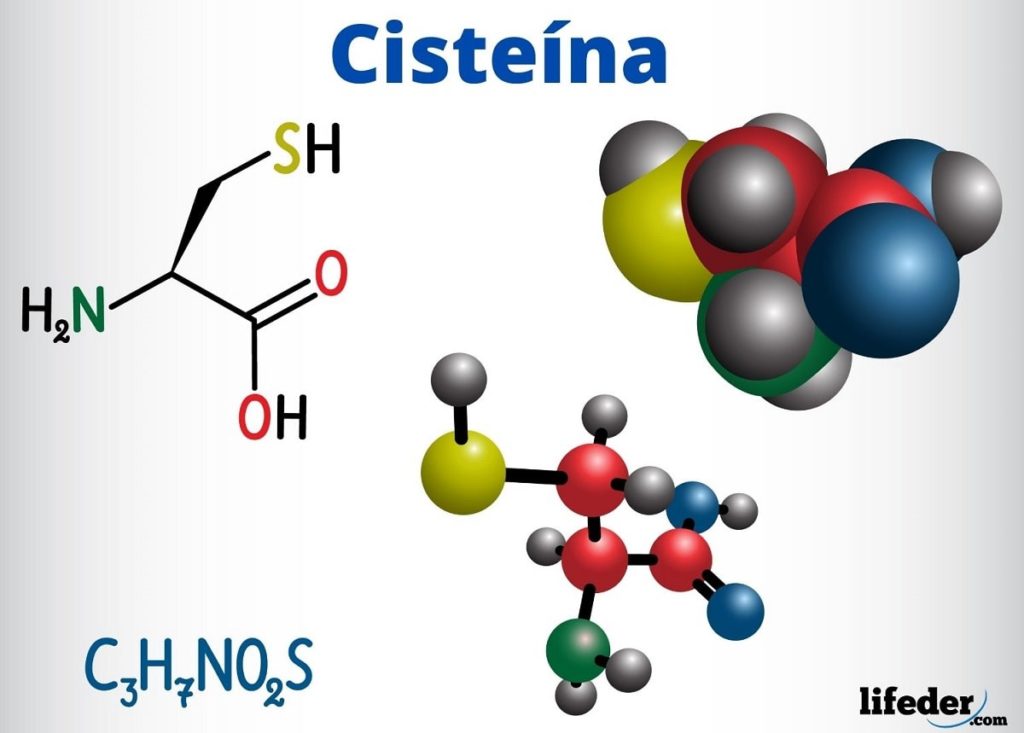
La cisteína es un aminoácido capaz de formar puentes disulfuros en su cadena proteica, siendo por ello, responsable de la estructura terciaria de una proteína. Asimismo, puede formar puentes disulfuros entre diferentes cadenas proteicas, originando la estructura cuaternaria de las proteínas.
La cisteína se encuentra en los centros activos de numerosas enzimas y además tiene una acción antioxidante.
El glutatión es un tiol que tiene una acción intracelular antioxidante muy importante, confiriendo protección a las células y a las macromoléculas que la componen.
La coenzima A, por otra parte, es un tiol que interviene en la síntesis y oxidación de los ácidos grasos. Además, la coenzima A bajo la forma de acetilcoenzima A, interviene en el inicio del ciclo del ácido cítrico o ciclo de Krebs.
Para finalizar se enlistarán algunos nombres de tioles acompañados de sus fórmulas moleculares:
-Ácido tioacético (C2H4OS)
-Coenzima A (C21H36N7O16P3S)
-Glutationa reducida (C10H17N3O6S)
-Cisteína (C3H7NO2S)
-Mercaptoetanol (C2H6OS)
-Metanotiol (CH3SH)
-1-Propanotiol (C3H7SH)
-Butanotiol (C4H 9SH)
-Tiofenol o tiomerosal (C6H6S)
-Mercaptano de pomelo (C10H18S)
-Hexadecanotiol (C6H34S)
-Penicillamina (C6H11NO2S)
-Captopril (C9H15NO3S)
-Etanotiol (C2H6S)
-2-propenetiol (C3H6S)
-Ácido α-lipoico o lipoamida (C8H14O2S2). Es un disulfuro cíclico.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Morrison y Boyd. (1987). Química orgánica. (Quinta edición). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Thiol. Recuperado de: en.wikipedia.org
- Dr. Dietmar Kennepohl et al. (13 de septiembre de 2020). Thiols and Sulfides. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- The Editors of Encyclopaedia Britannica. (2020). Thiol. Recuperado de: britannica.com
- Nolan MD and Scanlan EM (2020) Applications of Thiol-Ene Chemistry for Peptide Science. Front. Chem. 8:583272. doi: 10.3389/fchem.2020.583272
- Dr. Carl C. Wamser. (1999). Chapter 9: Alcohols and Thiols. Recuperado de: web.pdx.edu
