Agar CLED: fundamento, usos y preparación
El agar CLED (Cistina-Lactosa-Electrolitos-Deficiente) es un medio de cultivo sólido diferencial, utilizado para el diagnóstico de infecciones de las vías urinarias. La composición del medio de cultivo está diseñada para el buen crecimiento de los patógenos urinarios y es ideal para la cuantificación de las unidades formadoras de colonias (UFC).
El medio de cultivo CLED es no selectivo, ya que en él pueden crecer microorganismos Gram negativos y también Gram positivos. Pero esto no es un problema, ya que la mayoría de las infecciones urinarias son causadas por un solo tipo de microorganismo.
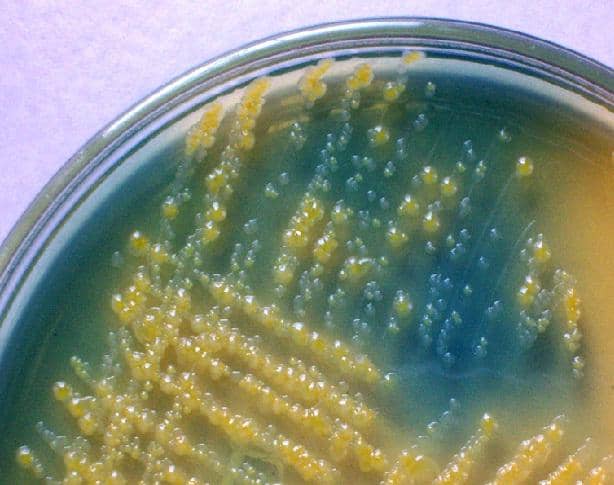
En caso de infecciones polimicrobianas se pueden conseguir 2 o 3 bacterias diferentes, pero es muy poco frecuente y la mayoría de las veces se trata de muestras contaminadas.
Entre las bacterias Gram negativas que pueden crecer en este medio se encuentran los bacilos pertenecientes a la familia Enterobacteriaceae y otros bacilos entéricos, siendo los uropatógenos más frecuentemente aislados en muestras de orina los siguientes: Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis,Morganella morganii,Pseudomonas aeruginosa, entre otros.
Así mismo, entre las bacterias Gram positivas que pueden crecer en este medio están Staphylococcus aureus, Staphylococcus saprophyticus, Enterococcus faecalis, Streptococcus agalactiae, Corynebacterium sp, Lactobacillus sp e incluso pueden crecer levaduras, como el complejo Candida albicans.
Sin embargo, debido a la composición química del medio no permite el crecimiento de algunos patógenos genitourinarios exigentes, como Neisseria gonorrhoeae, Gardnerella vaginalis, entre otros.
Índice del artículo
El medio de cultivo CLED posee como fuente de energía extracto de carne, hidrolizado pancreático de caseína e hidrolizado de gelatina. Los mismos proporcionan los nutrientes para el desarrollo de bacterias poco exigentes.
También contiene cistina, un aminoácido que permite el crecimiento de coliformes, distinguibles por su pequeño tamaño.
Así mismo, contiene como carbohidrato fermentable la lactosa, por este motivo este medio es diferencial; pudiéndose distinguir las bacterias fermentadoras de las no fermentadoras de lactosa.
Las bacterias fermentadoras hacen virar el pH del medio por la producción de ácidos, desarrollando colonias de color amarillo, mientras que las bacterias no fermentadoras no generan cambios en el medio, por tanto toman la coloración del agar original, color verde.
La reacción de fermentación es revelada gracias a la presencia del indicador de pH, que en este medio es el azul de bromotimol.
Por otra parte, la baja concentración de electrolitos del medio inhibe el típico crecimiento invasivo del género Proteus, denominado efecto swarming. Esto genera una ventaja con respecto a otros medios, ya que permite el contaje de las UFC, incluyendo si está presente el género Proteus.
Sin embargo, la baja concentración de electrolitos inhibe el crecimiento de algunas especies del género Shigella, siendo esta una desventaja con respecto a otros medios.
Existe una variante o modificación de este medio realizada por Bevis, quien incorporó a la composición original fucsina ácida (indicador de Andrade). El mismo actúa en conjunto al azul de bromotimol para diferenciar las bacterias fermentadoras de las no fermentadoras.
La diferencia entre el medio convencional y el modificado es el color que adoptan las colonias. En el caso de las bacterias fermentadoras de la lactosa, las colonias adquieren un color naranja rojizo con un halo rosa o rojo, en tanto que las no fermentadoras son de color gris-azulado.
El agar CLED se usa exclusivamente para el sembrado de muestras de orina. El uso de este medio es especialmente frecuente en laboratorios europeos, mientras que en América es menos utilizado.
La recolección de la muestra debe cumplir ciertos parámetros para obtener resultados confiables, entre ellos:
- No estar tomando antibióticos antes de la toma de muestra.
- Tomar preferiblemente la orina de la primera hora de la mañana, ya que es más concentrada, cuando no sea posible la toma de muestra por métodos invasivos.
- Lavar bien los genitales antes de tomar la muestra.
- Descartar el primer chorro de micción y luego colocar el envase.
- Recolectar entre 25 a 30 ml de la orina en envase estéril bien rotulado.
- Llevar inmediatamente al laboratorio rodeado en hielo.
- Debe ser procesado antes de las 2 horas de emitida o refrigerarse a 4°C por un máximo de 24 horas.
La muestra de orina se debe diluir 1:50.
Para la dilución coloque 0,5 ml de orina del paciente y diluya con 24,5 ml de solución fisiológica estéril.
Mida 0,1 ml de la orina diluida y siembre por superficie con espátula de drigalski sobre el medio CLED. Este es el método de sembrado indicado para contar colonias. Por eso se utiliza en muestras de orinas, ya que los resultados deben expresarse en UFC/ml.
Para la cuantificación de las colonias obtenidas, proceda de la siguiente manera: cuente las colonias de la placa y multiplique por 10 y luego por 50. Así obtiene la cantidad de UFC/ml de orina.
Contajes por encima de 100.000 UFC/ml —–Indica infección urinaria
Contajes por debajo de 1000 UFC/ml—– No hay infección
Contajes entre 1000-10.000 UFC/ml —–Dudoso, posible contaminación, repetir toma de muestra.
A las colonias crecidas en agar CLED se le deben hacer un Gram y dependiendo de las características morfotintoriales del microorganismo se realiza un determinado subcultivo.
Por ejemplo, si es un bacilo Gram negativo se sembrará sobre un agar MacConkey, donde se corrobora la fermentación o no de la lactosa. Además, se anexa un agar nutritivo para realizar la prueba de la oxidasa.
En caso de que el Gram revele cocos Gram positivos se puede subcultivar en agar manitol salado y en agar nutritivo. En este último se realiza la prueba de la catalasa. Por último, si se observan levaduras se sembrará sobre un agar Sabouraud.
Muchos laboratorios obvian el uso del medio CLED y prefieren solo usar agar sangre, MacConkey y agar nutritivo para sembrar las muestras de orina.
En una fiola con un litro de agua destilada disuelva 36,2 gr de agar CLED en polvo. Después de 5 minutos de reposo, caliente el agar resuspendido, mezclando constantemente hasta dejar hervir por 1 minuto.
Luego esterilizar a 121°C por 15 minutos en el autoclave. Culminado el tiempo, se retira del autoclave y se deja enfriar hasta alcanzar una temperatura de 45°C. Posteriormente se sirve entre 15 – 20 ml en cada placa de Petri estéril.
El procedimiento de servido de las placas se debe llevar a cabo dentro en una campana de flujo laminar o frente al mechero de Bunsen para evitar su contaminación.
Las placas servidas se dejan solidificar, se ordenan en un portaplaquero de forma invertida y se guarda en nevera (2-8°C) hasta su uso.
El pH final del medio preparado debe quedar en 7,3 ± 0,2.
- Recomendaciones para el diagnóstico microbiológico de la infección urinaria. chil. infectol. 2001; 18 (1): 57-63. Disponible en: scielo.org.
- Panchi J. Identificación del agente microbiano causante de infecciones urinarias en pacientes internos sometidos a cateterismo vesical. 2016. Trabajo de Grado para optar al título de Licenciada en Laboratorio Clínico. Universidad Técnica de Ambato. Ecuador.
- Laboratorios Britania. Medio CLED. Disponible en: britanialab.com.
- Laboratorios Renylab. Instrucciones de uso, Agar CLED. 2013 Disponible en: es.renylab.ind.br.
- Laboratorios Cultimed. Manual básico de Microbiología. Disponible en: ictsl.net.
- Muñoz P, Cercenado E, Rodríguez-Créixems M, Díaz MD, Vicente T, Bouza E. The CLED agar option in urine culture routine. A prospective and comparative evaluation. Diagn Microbiol Infect Dis. 1992; 15 (4):287-90.
- García P, Paredes F, Fernández del Barrio M. (1994). Microbiología clínica práctica. Universidad de Cadiz, 2da edición. Servicio de Publicaciones UCA.
