Agar MacConkey: fundamento, preparación y usos
El agar MacConkey es un medio de cultivo sólido que permite el aislamiento exclusivo de bacilos Gram negativos. Por esta razón es un medio selectivo y además permite distinguir entre bacilos fermentadores y no fermentadores de la lactosa, lo que lo hace un medio diferencial. Es uno de los medios de cultivo más utilizado en un laboratorio de microbiología.
Este medio se usa principalmente para el aislamiento de bacilos Gram negativos pertenecientes a la familia Enterobacteriaceae, incluyendo las especies oportunistas y las enteropatógenas.
También se puede usar para aislar a otros bacilos entéricos que habitan en el tracto gastrointestinal, pero que no pertenecen a Enterobacteriaceae, como Aeromonas sp, Plesiomonas sp, entre otros.
Finalmente, puede aislar otros bacilos Gram negativos no fermentadores de glucosa que se encuentran en ambiente, agua o suelos, pero que en ocasiones pueden ser patógenos oportunistas como Pseudomonas sp,Acinetobacter sp, Alcalígenes sp, Chromobacterium violaceum, Stenotrophomonas maltophilia, entre otros.
Índice del artículo
- 1 Fundamento
- 2 Preparación
- 3 Usos del agar MacConkey convencional
- 4 Otras variantes de agar MacConkey
- 5 Referencias
El fundamento de este medio se puede explicar a través de la descripción de sus componentes, pues cada uno posee una finalidad que determina una propiedad del mismo.
Sales biliares y cristal violeta
En este sentido, el agar MacConkey tiene una composición compleja. En primer lugar contiene sales biliares y cristal violeta.
Estos elementos se encargan de inhibir el crecimiento de bacterias Gram positivas y algunos bacilos Gram negativos exigentes. A su vez favorece el desarrollo de los bacilos Gram negativos que no son afectados por estas sustancias. Por ello es un medio selectivo.
Se dice que es ligeramente selectivo en comparación a otros medios que igualmente inhiben el crecimiento de bacterias Gram positivas y también de la mayoría de las bacterias Gram negativas.
Peptonas, polipectonas y lactosa
Contiene sustancias que aportan los nutrientes necesarios a los microorganismos que se desarrollan en este medio, como las peptonas, polipectonas y la lactosa.
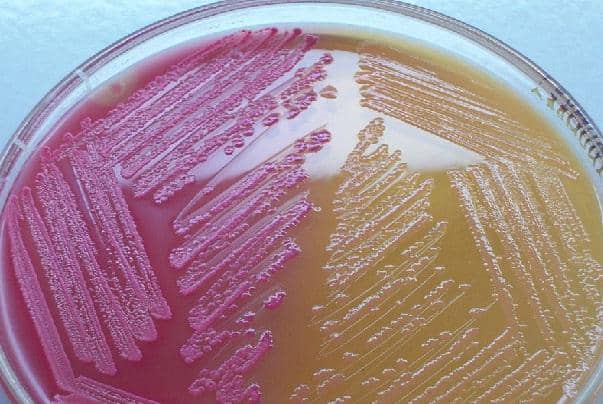
La lactosa es el punto clave para que el medio sea un medio diferencial, pues los microorganismos que poseen la capacidad para fermentar la lactosa desarrollaran colonias rosadas fuertes.
Algunas bacterias pueden fermentar la lactosa lentamente o débilmente, desarrollando colonias color rosado pálido y siguen siendo lactosa positiva.
Las que no fermentan la lactosa utilizan las peptonas como fuente de energía, produciendo amoníaco, alcalinizando el medio. Por ello las colonias que se originan son incoloras o transparentes.
Indicador de pH
El cambio de color se logra a través de otro compuesto esencial que posee el agar MacConkey. Este compuesto es el indicador de pH, que en este caso es el rojo neutro.
La fermentación de la lactosa genera la producción de ácidos mixtos. Los mismos acidifican el medio a un pH por debajo de 6,8.
Esto hace que el indicador de pH vire hacia a una tonalidad rosada intenso. La intensidad del color puede variar dependiendo el pH final.
Agua destilada, cloruro de sodio y agar
Por otra parte, contiene agua destilada y cloruro de sodio que le dan la hidratación y equilibrio osmótico al medio. Finalmente, el medio contiene agar, que es la base que proporciona la consistencia de medio sólido.
El medio agar MacConkey preparado debe tener un pH final ajustado a 7,1 ± 0,2.
Para un litro de agar MacConkey se debe pesar 50 gr del medio deshidratado, luego se coloca en una fiola y se disuelve en un litro de agua destilada. Después de 10 minutos de reposo se calienta mezclando constantemente hasta dejar hervir por 1 minuto.
Luego se coloca la fiola en el autoclave y se esteriliza a 121°C por 20 minutos. Culminado el tiempo, se saca del autoclave y se deja enfriar hasta alcanzar una temperatura de 45°C, para posteriormente servir en placas de Petri estériles dentro de una campana de flujo laminar o frente al mechero de Bunsen.
Dejar solidificar y guardar en un portaplaquero de forma invertida y refrigerar en nevera a 2-8°C hasta su uso.
Para obtener un agar MacConkey que inhiba el efecto swarning que produce el género Proteus se usa un agar MacConkey bajo en sal.
El agar MacConkey se incluye en todos los set de medios de cultivos dispuestos para la siembra de las muestras clínicas recibidas en el laboratorio. También es útil en microbiología de alimentos y microbiología ambiental.
La variedad de bacilos Gram negativos que crecen en este medio expresan características fenotípicas que ayudan a un diagnóstico presuntivo de la especie en cuestión. Por ejemplo el tamaño, color, consistencia y olor de las colonias, son algunas de las características que pueden orientar.
En este medio las especies de Escherichia coli, Klebsiella sp y Enterobacter sp producen colonias rosadas fuertes, rodeadas de una zona de bilis precipitada.
En tanto que, las bacterias como Citrobacter sp, Providencia sp, Serratia sp y Hafnia sp pueden aparecer sin color después de 24 horas o rosa pálido en 24 -48 horas.
Así mismo, los géneros Proteus, Edwadsiella, Salmonella y Shigella producen colonias incoloras o transparentes.
Existen otras variantes de agar MacConkey que tienen finalidades específicas. A continuación se mencionan:
Este medio fue diseñado para distinguir la cepa enteropatógena (Escherichia coli enterohemorrágica O157:H7) del resto de las cepas de Escherichia coli.
Este medio cambia el carbohidrato lactosa por sorbitol. Las cepas de E. coli enterohemorrágicas O157:H7 se diferencian del resto porque no fermentan el sorbitol y por tanto se obtienen colonias transparentes, en cambio el resto de las cepas E. coli si fermentan el sorbitol y las colonias son rosadas fuertes.
Este agar difiere mucho del agar MacConkey clásico, pues al no tener cristal violeta pueden crecer bacterias Gram positivas.
Por otra parte, la ausencia de sal inhibe la aparición de swarming sobre el agar producido por algunos bacilos entéricos, como los del género Proteus, y así facilitar el aislamiento de todas las bacterias presentes, incluyendo bacterias Gram positivas.
Esta variante de agar MacConkey fue diseñada para aislar inicialmente Laribacter hongkongensis y posteriormente se dieron cuenta que era útil para el aislamiento de Arcobacter butzleri. Ambos son bacilos Gram negativos ligeramente curvados resistentes a cefoperazone.
Estas bacterias han sido recientemente vinculadas como causantes de gastroenteritis y diarreas adquiridas en individuos asiáticos y europeos, perfilándose como dos potentes patógenos emergentes.
El antibiótico permite inhibir la flora acompañante del tracto gastrointestinal, lo que favorece el desarrollo de estas bacterias, evitando que pasen desapercibidas, ya que las mismas requieren 72 horas para crecer.
Esta variante es útil para la evaluación de indicadores sanitarios bacterianos de contaminación fecal, entre ellas coliformes totales y coliformes fecales en aguas saladas recreacionales (playas y Bahías).
Cortez y col en el 2013 demostraron que el medio preparado de esta manera aumenta significativamente la recuperación de estos microorganismos en el ambiente salino, en comparación con el uso de agar MacConkey preparado con agua destilada.
Esto se debe a que en el medio modificado se estimula el crecimiento de bacterias que están de forma fisiológica en un estado de latencia “viables pero no cultivables”, por tanto no son recuperables en medios convencionales.
- Lau SK, Woo PC, Hui WT, et al. Use of cefoperazone MacConkey agar for selective isolation of Laribacter hongkongensis. J Clin Microbiol. 2003; 41(10):4839-41.
- “Agar MacConkey.” Wikipedia, La enciclopedia libre. 4 abr 2018, 18:16 UTC. 29 dic 2018, 15:22 es.wikipedia.org
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnóstico Microbiológico de Bailey & Scott. 12 ed. Argentina. Editorial Panamericana S.A.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnóstico Microbiológico. (5ta ed.). Argentina, Editorial Panamericana S.A.
- Cortez J, Ruiz Y, Medina L, Valbuena O. Efecto de medios de cultivo preparados con agua de mar sobre indicadores sanitarios en aguas marinas de balnearios de Chichiriviche, estado Falcón, Venezuela. Rev Soc Ven Microbiol 2013; 33:122-128
- García P, Paredes F, Fernández del Barrio M. (1994). Microbiología clínica práctica. Universidad de Cadiz, 2da edición. Servicio de Publicaciones UCA.
