Sulfato de potasio (K2SO4): estructura, propiedades, usos, síntesis
El sulfato de potasio es una sal inorgánica de color blanco o incoloro cuya fórmula química es K2SO4. Ya era conocida en el siglo XIV, denominándose en el siglo XVII como sal duplicatum, pues es una combinación de una sal ácida y una sal alcalina.
El sulfato de potasio se encuentra en forma mineral en la arcanita, pero es más común su presentación en las llamadas sales de Stassfurt. Estas son cocristalizaciones de sulfatos de potasio, magnesio, calcio y sodio, observables en minerales como la leonita y la polihalita.
El sulfato de potasio es una sal poco tóxica y solo produce irritaciones por contacto con los ojos, el tracto respiratorio o el tracto digestivo. No hay evidencia de una acción carcinogénica o mutagénica.
El sulfato de potasio se usa como fertilizante, especialmente en los cultivos que son susceptibles a los cloruros; tal es el caso del tabaco y la papa o patata. El compuesto aporta potasio, uno de los tres nutrientes principales de las plantas, y azufre, el cual está presente en sus proteínas.
Índice del artículo
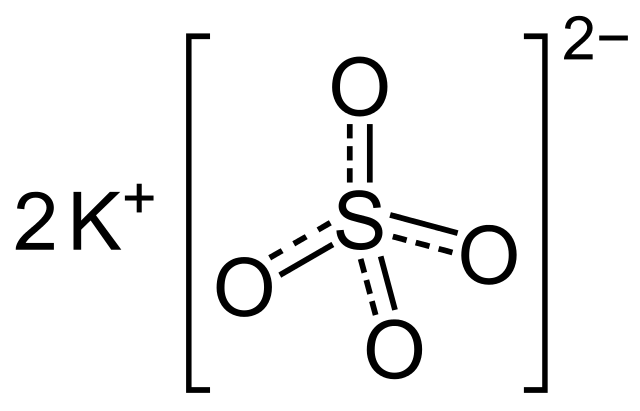
En la primera imagen se mostró la fórmula estructural del sulfato de potasio. Por cada anión SO42-, de geometría tetraédrica, hay dos cationes K+, los cuales pueden ser representados por esferas moradas (imagen superior).
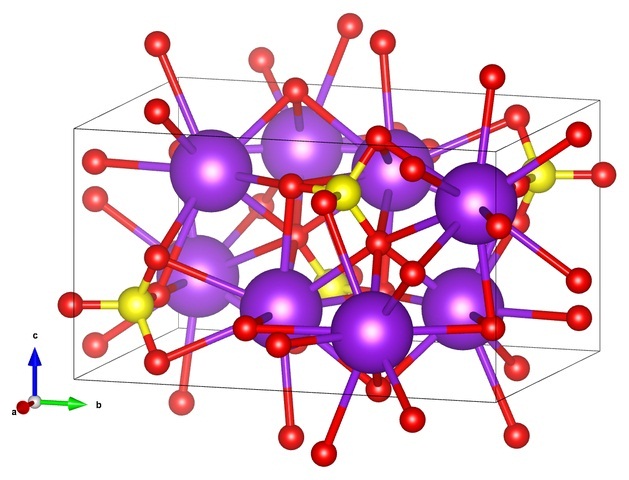
Así pues arriba se tiene la estructura cristalina ortorrómbica del K2SO4, con los aniones SO42- representados por esferas amarillas y rojas; mientras que los cationes K+, ya dicho, son las esferas moradas (un poco robustecidas).
Esta representación puede ocasionar confusión si se piensa que realmente las barras corresponden a enlaces de coordinación. Más bien, indican qué ion interacciona directa o cercanamente con otro de su alrededor. Es por eso que cada oxígeno se “conecta” con cinco K+ (O3SO2-— K+), y estos a su vez con diez oxígenos de otros aniones sulfatos circundantes.
Se tiene entonces una esfera coordinación algo “rara” para el potasio en el K2SO4:
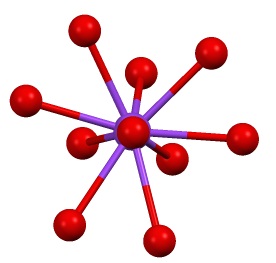
Esta estructura cristalina corresponde al polimorfo β-K2SO4. Cuando se calienta hasta los 583 ºC, ocurre una transición a la fase α-K2SO4, la cual es hexagonal.
Ciertamente la estructura del K2SO4 es inusualmente complicada para una sal inorgánica. Sus iones se hallan posicionados formando una especie de maraña sin sentido y, a simple vista, carente de periodicidad.
Quienes se dedican a la cristalografía pueden abordar dicha maraña de manera más apropiada y descriptiva, observándola desde los tres ejes espaciales.
Nótese que su estructura enmarañada podría explicar por qué el K2SO4 no forma hidratos: las moléculas H2O no tienen cómo penetrar la red cristalina para hidratar los cationes de potasio.
Asimismo, con tantas interacciones abarcadas en la maraña de iones, es de esperar que dicha red cristalina tenga bastante estabilidad frente al calor; y de hecho así ocurre, ya que el punto de fusión del K2SO4 es 1,069 ºC, lo cual demuestra que sus iones se hallan fuertemente cohesionados.
-Sulfato de potasio
-Sulfato de potasa
-Arcanita
-Potasa de sulfuro
174,259 g/mol
Sólido de cristales, gránulos o polvo blancos, inodoros y de sabor amargo.
2,66 g/cm3
1.069 ºC
1.689 ºC
111 g/L a 20 ºC
120 g/L a 25 ºC
240 g/L a 100 ºC
La solubilidad en el agua decrece por la presencia del cloruro de potasio, KCl o sulfato de amonio, (NH4)2SO4, debido al efecto del ion común.
Ligeramente soluble en glicerol, pero insoluble en acetona y sulfuro de carbono.
1,495
El sulfato de potasio puede reaccionar con el ácido sulfúrico, acidificándose para formar el bisulfato de potasio (KHSO4). Puede ser reducido a altas temperaturas a sulfuro de potasio (K2S).
El sulfato de potasio se sintetiza mediante la reacción del cloruro de potasio con el ácido sulfúrico. La síntesis del sulfato de potasio ocurre en dos pasos. El primer paso envuelve la formación de bisulfato de potasio.
Esta es una reacción exotérmica, ya que libera calor y, por lo tanto, no requiere del suministro de calor externo. La reacción se realiza a la temperatura ambiente.
KCl + H2SO4 => HCl + KHSO4
El segundo paso de la reacción es endotérmico, es decir, que requiere del suministro de calor para que pueda producirse.
KCl + KHSO4 => HCl + K2SO4
Se puede sintetizar sulfato de potasio mediante la reacción de neutralización del ácido sulfúrico con una base, el hidróxido de potasio:
H2SO4 + 2 KOH => K2SO4 + 2 H2O
Se produce sulfato de potasio por la reacción del dióxido de azufre, oxígeno, cloruro de potasio y agua.
Se produce sulfato de potasio mediante la extracción del sulfato de potasio presente en una salmuera de la cuenca de Loop Nur, China. El sulfato de potasio se separa de los componentes insolubles de la salmuera mediante la adición del compuesto acidificante tripolifosfato sódico / fosfato de urea.
Este compuesto aumenta la diferencia entre la solubilidad del sulfato de potasio y la solubilidad de los otros compuestos menos solubles, lográndose, según lo creadores del método, un sulfato de potasio 100 % puro. En sentido estricto no es un método de síntesis, pero es un método de extracción novedoso.

El uso del sulfato de potasio como fertilizante es su principal aplicación. El 90% de su producción total se usa para este propósito. Su empleo se prefiere al del cloruro de potasio en aquellos cultivos que son sensibles a la presencia del cloruro en el suelo; por ejemplo el de tabaco.
El sulfato de potasio tiene un contenido de potasio del 40-44%, mientras su concentración de azufre representa el 17-18% del compuesto. El potasio es necesario para realizar muchas funciones esenciales para las plantas, ya que activa reacciones enzimáticas, síntesis de proteínas, formación del almidón, etc.
Además, el potasio interviene en la regulación del flujo del agua en las hojas. El azufre es necesario para la síntesis de proteínas, ya que está presente en aminoácidos que lo poseen; tal es el caso de la metionina, la cisteína y la cistina, y también interviene en reacciones enzimáticas.
Inclusive, el sulfato de potasio se usa por aspersión sobre las hojas en partículas de sulfato de potasio más pequeñas que 0,015 mm.
El sulfato de potasio crudo se utiliza en la fabricación del vidrio y en la manufacturación del alumbre y carbonato de potasio. Se usa como reactivo en la fabricación de cosméticos. Se utiliza en la fabricación de la cerveza como agente correctivo del agua.
Se emplea para corregir una disminución severa en la concentración plasmática de potasio (hipokalemia), producto de un uso excesivo de diuréticos que aumenten la excreción urinaria de potasio.
El potasio es el principal ion intracelular de las células excitables, entre ellas las cardíacas. Por lo que una disminución severa del potasio en el plasma compromete el funcionalismo cardíaco, debiéndose corregir de inmediato.
El sulfato de potasio tiene una acción catártica, es decir, favorece la expulsión de las heces del colon. Por esta razón se usa una mezcla de los sulfatos de potasio, magnesio y sodio para despejar el colon de heces antes de realizar una colonoscopia, lo cual permite una mejor visualización del colon por el médico.
Se ha empleado el sulfato de potasio para disminuir el requerimiento de la metionina en la alimentación de las aves de corral. La presencia de un 0,1 % de sulfato de potasio en los alimentos de las gallinas ponedoras, está asociada con un incremento del 5 % en la producción de huevos.
Es un agente saborizante que le confiere a los alimentos un sabor amargo y salino que es deseable en algunos de ellos. Además, se señala que el sulfato de potasio está dotado de los cuatro sabores básicos: dulzura, amargor, acidez y salinidad.
La salinidad, la acidez y el amargor aumentan con la concentración del sulfato de potasio, mientras la dulzura disminuye.
El sulfato de potasio se usa como un pirotécnico, en combinación con nitrato de potasio, para generar una llama de color púrpura. Se utiliza como reductor de destello en las cargas de los propulsores de artillería.
Además, se emplea como un agente que incrementa la viscosidad en productos cosméticos como las cremas faciales.
El sulfato de potasio es un compuesto poco tóxico y de muy baja letalidad. El LD50 para la dosis oral en los ratones es de 6.600 mg / kg de peso del animal, lo cual indica que se requiere de una dosis alta para producir la muerte del ratón. El mismo valor de LD50 se presenta en las ratas.
En los ojos, por contacto, el sulfato de potasio puede producir una irritación mecánica. En la piel, el sulfato de potasio provoca poco daño para el manejo industrial que se hace de él.
Por ingestión, el sulfato de potasio puede ocasionar irritación gastrointestinal con náusea, vómito y diarrea. Y por último, la inhalación del polvo de sulfato de potasio causa irritación en el tracto respiratorio.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2019). Potassium sulfate. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2019). Potassium sulfate. PubChem Database. CID=24507. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Brian Clegg. (05 de julio de 2018). Potassium sulfate. Royal Society of Chemistry. Recuperado de: chemistryworld.com
- Marie T. Averbuch-Pouchot, A. Durif. (1996). Topics in Phosphate Chemistry. World Scientific. Recuperado de: books.google.co.ve
- Chemical Book. (2017). Potassium sulfate. Recuperado de: chemicalbook.com
- Shoujiang L. et al. (2019). Purification and rapid dissolution of potassium sulfate in aqueous solutions. DOI: 10.1039/C8RA08284G
- DrugBank. (2019). Potassium sulfate. Recuperado de: drugbank.ca
- The Mosaic Company. (2019). Potassium sulfate. Crop Nutrition. Recuperado de: cropnutrition.com
- Drugs. (2018). Sodium sulfate, potassium sulfate, and magnesium sulfate (Oral). Recuperado de: drugs.com
