Tirosina: características, estructura, funciones, beneficios
La tirosina (Tyr, Y) es uno de los 22 aminoácidos que conforman a las proteínas de todas las células presentes en los seres vivos. A diferencia de otros aminoácidos como la valina, la treonina, el triptófano, la leucina, la lisina y otros, la tirosina es un aminoácido “condicionalmente” esencial.
El nombre “tirosina” deriva del vocablo griego “tiros”, que significa queso, pues este aminoácido fue descubierto por primera vez en este alimento. El término fue acuñado en 1846 por Liebig, quien mezcló queso con hidróxido de potasio y obtuvo un compuesto desconocido, difícilmente soluble en agua.
Luego de la descripción inicial, otros investigadores como Warren de la Rue y Hinterberger la obtuvieron a partir de insectos cocoideos y de proteínas de cuernos, respectivamente. Su separación a partir de la hidrólisis de otras proteínas con ácido hidroclórico fue descrita en 1901 por Mörner.
Generalmente, este aminoácido es obtenido en los mamíferos gracias a la hidroxilación de la fenilalanina, aunque también es absorbida en el intestino a partir de las proteínas consumidas con los alimentos.
La tirosina tiene múltiples funciones en el cuerpo humano y entre estas las más relevantes son, tal vez, la de sustrato para la producción de neurotransmisores y hormonas como la adrenalina y la hormona tiroidea.
Índice del artículo
- 1 Características
- 2 Estructura
- 3 Funciones
- 4 Biosíntesis
- 5 Degradación
- 6 Alimentos ricos en tirosina
- 7 Beneficios de su ingesta
- 8 Trastornos por deficiencia
- 9 Referencias
La tirosina pesa aproximadamente 180 g/mol y su grupo R o cadena lateral tiene una constante de disociación pKa de 10.07. Su abundancia relativa en las proteínas celulares no supera el 4%, pero tiene múltiples funciones esenciales para la fisiología humana.
Este aminoácido pertenece al grupo de los aminoácidos aromáticos, en el que también se hallan la fenilalanina y el triptófano. Los integrantes de este grupo poseen anillos aromáticos en sus grupos R o cadenas laterales y, por lo general, son aminoácidos hidrofóbicos o apolares.
Al igual que el triptófano, la tirosina absorbe luz ultravioleta y es uno de los residuos aminoacídicos responsables de la absorbancia de luz a 280 nm de muchas proteínas, por lo que es útil para su caracterización.
Se considera un aminoácido “condicionalmente” esencial puesto que su biosíntesis en el ser humano depende de la fenilalanina, un aminoácido esencial. Si el cuerpo satisface sus requerimientos diarios de fenilalanina, la tirosina puede ser sintetizada sin problema y no es un aminoácido limitante.
No obstante, si la dieta es carente en fenilalanina, el cuerpo no sólo tendrá un desbalance de este aminoácido, sino también de tirosina. Es importante señalar, además, que la reacción de síntesis de tirosina a partir de fenilalanina no es reversible, por lo que la tirosina no puede suplir las necesidades celulares de fenilalanina.
La tirosina también pertenece al grupo de aminoácidos con funciones duales en la producción de intermediarios metabólicos glucogénicos y cetogénicos, que participan en la síntesis de glucosa para el cerebro y en la formación de cuerpos cetónicos en el hígado.
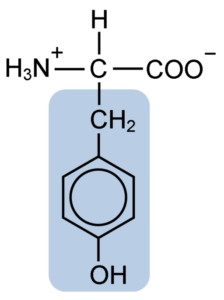
Al igual que el resto de los aminoácidos, la tirosina, o el ácido β-parahidroxifenil-α-amino propiónico, es un α-aminoácido que posee un átomo de carbono central, denominado carbono α y que es quiral, pues está unido a cuatro átomos o moléculas sustituyentes diferentes.
Este carbono quiral está unido a dos grupos característicos de los aminoácidos: un grupo amino (NH2) y un grupo carboxilo (COOH). También comparte uno de sus enlaces con un átomo de hidrógeno y el enlace restante está ocupado por el grupo R o cadena lateral propio de cada aminoácido.
En el caso de la tirosina, este grupo consiste en un anillo aromático asociado con un grupo hidroxilo (OH), que le da la capacidad de formar puentes de hidrógeno con otras moléculas y que le otorga características funcionales esenciales para ciertas enzimas.
La tirosina es un componente fundamental de muchas proteínas con gran diversidad de actividades y funciones biológicas.
En los seres humanos y otros mamíferos, este aminoácido es aprovechado en los tejidos nerviosos y renales para la síntesis de dopamina, adrenalina y noradrenalina, tres neurotransmisores catecolaminérgicos relacionados de suma importancia para el funcionamiento corporal.
También es esencial para la síntesis de protectores de radiación ultravioleta (UV) como la melanina; de algunos analgésicos como las endorfinas y de moléculas antioxidantes como la vitamina E.
Del mismo modo, este aminoácido sirve para la síntesis de la tiramina, de la octopamina y de las hormonas tiroideas a través de la organificación del yodo en el residuo de tirosina de la tiroglobulina.
La tiramina es una molécula vasoactiva que se encuentra en el cuerpo humano y la octopamina es una amina relacionada con la noradrenalina.
Todas estas funciones de la tirosina son posibles gracias a su obtención a partir de las proteínas de la dieta o por hidroxilación de la fenilalanina con el hígado como el principal órgano de suministro sistémico de dicho aminoácido.
La tirosina y algunos de los intermediarios generados durante su biosíntesis alimentan las rutas biosintéticas de metabolitos especializados en la defensa, en la atracción de los polinizadores, en el transporte electrónico y en el soporte estructural.
En el ser humano la tirosina es obtenida de la dieta o sintetizada en un solo paso por las células hepáticas a partir de la fenilalanina, un aminoácido esencial, a través de la reacción catalizada por el complejo enzimático fenilalanina hidroxilasa.
Este complejo tiene actividad oxigenasa y sólo está presente en el hígado de los humanos o de otros mamíferos. La reacción de síntesis de tirosina implica, entonces, la transferencia de un átomo de oxígeno a la posición para del anillo aromático de la fenilalanina.
Dicha reacción ocurre al mismo tiempo que se forma una molécula de agua por la reducción de otro átomo de oxígeno molecular y el poder reductor es aportado directamente por un NADPH conjugado con una molécula de tetrahidropterina, que es semejante al ácido fólico.
En las plantas, la tirosina es sintetizada de novo aguas abajo de la ruta del “shikimato”, que alimenta otras rutas biosintéticas de otros aminoácidos aromáticos como la fenilalanina y el triptófano.
En estos organismos la síntesis parte de un compuesto conocido como “corismato”, que es el producto final de la ruta del shikimato y, además, el precursor común para todos los aminoácidos aromáticos, ciertas vitaminas y hormonas vegetales.
El corismato es convertido en prefenato por la acción catalítica de la enzima corismato mutasa y es este el primer paso “comprometido” en la síntesis de la tirosina y la fenilalanina en las plantas.
El prefenato es convertido en tirosina por una descarboxilación oxidativa y una transaminación, que pueden ocurrir en cualquier orden.
En una de las rutas biosintéticas, estos pasos pueden ser catalizados por enzimas específicas conocidas como tirosina deshidrogenasa prefenato-específica (PDH) (que convierte el prefenato en 4-hidroxifenilpiruvato (HPP)) y tirosina aminotransferasa (que produce la tirosina a partir del HPP), respectivamente.
Otra vía de síntesis de tirosina a partir de prefenato implica la transaminación del prefenato a un aminoácido no proteinogénico llamado L-arogenato, catalizada por la enzima prefenato aminotransferasa.
El L-arogenato es posteriormente sometido a una descarboxilación oxidativa para formar tiroxina, reacción dirigida por una enzima tirosina deshidrogenasa arogenato-específica, conocida también como ADH.
Las plantas emplean preferencialmente la ruta del arogenato, mientras que la mayoría de los microbios sintetizan tirosina a partir del HPP derivado del prefenato.
Como es cierto para la mayor parte de las rutas biosintéticas de los aminoácidos, las plantas poseen un sistema estricto de regulación de la síntesis de los aminoácidos aromáticos, entre los que se incluye la tirosina.
En estos organismos, la regulación ocurre en muchos niveles, puesto que los mecanismos que controlan la ruta del shikimato, también controlan la producción de tirosina, ruta para la cual también existen mecanismos propios de regulación.
Sin embargo, los requerimientos de tirosina y, por lo tanto, la rigidez en la regulación de su biosíntesis, son específicos para cada especie vegetal.
La degradación o el catabolismo de la tirosina resulta en la formación de fumarato y acetoacetato. El primer paso de esta ruta consiste en la conversión del aminoácido en 4-hidroxifenilpiruvato por una enzima citosólica conocida como tirosina aminotransferasa.
Este aminoácido también puede ser transaminado en las mitocondrias de los hepatocitos por una enzima aspartato aminotransferasa, aunque esta enzima no es muy importante en condiciones fisiológicas normales.
A través de la degradación de la tirosina puede producirse succinil-acetoacetato, que puede ser descarboxilado a succinil-acetato. El succinil-acetato es el más potente inhibidor de la enzima responsable de la síntesis del grupo hemo, la enzima ácido 5-aminolevulínico deshidratasa.
Como se ha comentado, la tirosina es uno de los sustratos principales para la síntesis de dos neurotransmisores muy importantes para el cuerpo humano: la adrenalina y la noradrenalina.
Esta es empleada inicialmente por una enzima conocida como la tirosina hidroxilasa, capaz de añadir un grupo hidroxilo adicional al anillo aromático del grupo R de la tirosina, con lo que se forma el compuesto conocido como dopa.
La dopa da lugar a la dopamina una vez que es procesada enzimáticamente por una enzima dopa descarboxilasa, que remueve el grupo carboxilo del aminoácido de partida y que amerita de una molécula de fosfato piridoxal (FDP).
La dopamina, posteriormente, es convertida en noradrenalina por acción de la enzima dopamina β-oxidasa, que cataliza la adición de un grupo hidroxilo al -CH que formaba parte del grupo R de la tirosina y que funcionaba de “puente” entre el anillo aromático y el carbono α.
La adrenalina deriva de la noradrenalina por acción de la feniletanolamina N-metiltransferasa, que se encarga de la transferencia S-adenosil-metionina-dependiente de un grupo metilo (-CH3) al grupo amino libre de la noradrenalina.
Como se comentó anteriormente, la tirosina es un aminoácido “condicionalmente” esencial, pues es sintetizado en el cuerpo humano por hidroxilación de la fenilalanina, un aminoácido esencial.
Por lo tanto, si la ingesta de fenilalanina cubre las demandas corporales, la tirosina no es un factor limitante para el funcionamiento normal de las células. La tirosina, sin embargo, es adquirida también a partir de las proteínas que se consumen con los alimentos diarios.
Algunos estudios reportan que la ingesta diaria mínima tanto de tirosina como de fenilalanina debe estar entre los 25 y los 30 mg por kilogramo de peso, por lo que una persona promedio debería consumir más o menos 875 mg de tirosina por día.
Los alimentos con mayor contenido de tirosina son el queso y la soya. Entre estos también están la carne de res, de cordero, de cerdo, de pollo y de pescado.
Algunas semillas y frutos secos como las nueces también confieren aportes significativos de este aminoácido, así como los huevos, los productos lácteos, los granos y los cereales.
La tirosina es consumida comúnmente en forma de suplementos dietéticos o nutricionales, específicamente para el tratamiento de la patología conocida como fenilcetonuria, que sufren los pacientes incapaces de procesar adecuadamente la fenilalanina y, por lo tanto, no producen tirosina.
Se piensa que un aumento en la cantidad de tirosina consumida por día puede mejorar las funciones cognitivas relacionadas con el aprendizaje, la memoria y el estado de alerta en condiciones estresantes, pues su catabolismo está relacionado con la síntesis de los neurotransmisores adrenalina y noradrenalina.
Algunas personas toman comprimidos ricos en tirosina para mantenerse alertas durante el día si han perdido una cantidad importante de horas de sueño.
Como este aminoácido participa en la formación de la hormona tiroidea, su consumo puede tener efectos positivos en la regulación metabólica sistémica.
El albinismo y la alcaptonuria son dos patologías relacionadas con el metabolismo de la tirosina. La primera condición está relacionada con la síntesis defectuosa de melanina a partir de tirosina y la segunda tiene que ver con defectos en la degradación de la tirosina.
El albinismo se caracteriza por la falta de pigmentación en la piel, es decir, los pacientes que la padecen tienen cabello de color blanco y piel rosácea, pues la melanina es el pigmento encargado de proporcionar el color a estas estructuras.
Esta patología tiene que ver con una deficiencia en la enzima tirosinasa específica de los melanocitos, que es la responsable de convertir la tirosina en DOPA-quinona, un intermediario en la síntesis de la melanina.
Los síntomas de la alcaptonuria son evidentes como una pigmentación exagerada de la orina (oscura) y artritis de desarrollo tardío.
Además, existen otros desórdenes relacionados con el metabolismo de la tirosina, entre los que están:
– La tirosinemia hereditaria de tipo I: caracterizada por una degeneración hepática progresiva y disfunción renal
– La tirosinemia hereditaria de tipo II o el síndrome de Richner-Hanhart: que es evidente como una queratitis y lesiones ampulares en las palmas de las manos y las plantas de los pies
– La tirosinemia tipo III: que puede ser asintomática o presentarse como retrasos mentales
– La “Hawkinsinuria”: caracterizada por acidosis metabólica en la infancia y por la incapacidad de prosperar en el crecimiento
También existen otros defectos innatos en el metabolismo de la tirosina que tienen que ver con deficiencias en las enzimas encargadas de su degradación, como por ejemplo la tirosina hidroxilasa, encargada del primer paso de la síntesis de la dopamina a partir de tirosina.
- Aders Plimmer, R. (1908). The Chemical Constitution of The Proteins. Part I. London, UK: Longmans, Green, and CO.
- Chakrapani, A., Gissen, P., & McKiernan, P. (2012). Disorders of tyrosine metabolism. In Inborn Metabolic Diseases: Diagnosis and Treatment (pp. 265–276).
- Kretchmer, N., Levine, S., McNamara, H., & Barnett, H. (1956). Certain Aspects of Tyrosine Metabolism in the Young. I. The Development of the Tyrosine Oxidizing System in Human Liver. The Journal of Clinical Investigation, 35(10), 1089–1093.
- La Du, B., Zannoni, V., Laster, L., & Seegmiller, E. (1958). The Nature of the Defect in Tyrosine Metabolism in Alkaptonuria. Journal of Biological Chemistry, 230, 251–260.
- Murray, R., Bender, D., Botham, K., Kennelly, P., Rodwell, V., & Weil, P. (2009). Harper’s Illustrated Biochemistry (28th ed.). McGraw-Hill Medical.
- Nelson, D. L., & Cox, M. M. (2009). Lehninger Principios de Bioquímica. Ediciones Omega (5th ed.).
- Schenck, C. A., & Maeda, H. A. (2018). Tyrosine biosynthesis, metabolism, and catabolism in plants. Phytochemistry, 149, 82–102.
- Slominski, A., Zmijewski, M. A., & Pawelek, J. (2012). L-tyrosine and L-dihydroxyphenylalanine as hormone-like regulators of melanocyte functions. Pigment Cell and Melanoma Research, 25(1), 14–27.
- Van de, G. (2018). Health Line. Retrieved September 16, 2019, from www.healthline.com
- Web MD. (n.d.). Retrieved September 15, 2019, from www.webmd.com
- Whitbread, D. (2019). My Food Data. Retrieved September 15, 2019, from www.myfooddata.com
