Isoleucina: características, funciones, biosíntesis, alimentos
La isoleucina (Ile, I) es uno de los 22 aminoácidos presentes en la naturaleza como parte de las proteínas. En vista de que el cuerpo humano, al igual que el de algunos otros mamíferos, no puede sintetizarla, la isoleucina está entre los 9 aminoácidos esenciales que deben ser obtenidos con la dieta.
Este aminoácido fue aislado por primera vez en 1903 por el científico F. Ehrlich a partir de los constituyentes nitrogenados de melazas de betabel o remolacha. Posteriormente, el mismo autor separó la isoleucina a partir de los productos de descomposición de la fibrina y otras proteínas.
Es un aminoácido no polar presente en gran parte de las proteínas celulares de los organismos vivos, además, forma parte del grupo de los aminoácidos de cadena ramificada BCAAs (del inglés Branched Chain Amino Acids), junto con la leucina y la valina.
Tiene funciones en el establecimiento de la estructura terciaria de muchas proteínas y, además, participa en la formación de diversos precursores metabólicos relacionados con el metabolismo energético celular.
Índice del artículo
- 1 Características
- 2 Estructura
- 3 Funciones
- 4 Biosíntesis
- 5 Degradación
- 6 Alimentos ricos en isoleucina
- 7 Beneficios de su ingesta
- 8 Trastornos por deficiencia
- 9 Referencias
La isoleucina se clasifica dentro del grupo de los aminoácidos no polares con grupos o cadenas R de naturaleza alifática, es decir, con cadenas hidrocarbonadas hidrofóbicas.
Debido a dicha característica, los aminoácidos de este grupo como la alanina, la valina y la leucina, tienden a permanecer cerca unos de otros, lo que contribuye a la estabilización de las proteínas de que son parte por medio de interacciones hidrofóbicas.
Este aminoácido no polar pesa aproximadamente 131 g/mol y está presente en las proteínas en una proporción cercana al 6%, a menudo “enterrada” en el centro de las mismas (gracias a sus cualidades hidrofóbicas).
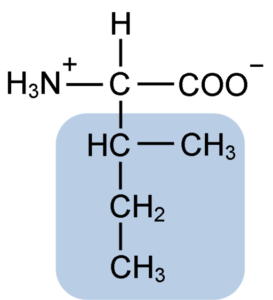
La isoleucina es un α-aminoácido que, como los demás aminoácidos, posee un átomo de carbono central denominado carbono α (que es quiral), al cual se unen cuatro grupos diferentes: un átomo de hidrógeno, un grupo amino (-NH2), un grupo carboxilo (-COOH) y una cadena lateral o grupo R.
El grupo R de la isoleucina consiste en un hidrocarburo ramificado sencillo de 4 átomos de carbono (-CH3-CH2-CH(CH3)) en cuya cadena se encuentra también un átomo de carbono quiral.
Debido a esta característica, la isoleucina tiene cuatro formas posibles: dos de ellas son los isómeros ópticos conocidos como L-isoleucina y D-isoleucina y las otras dos son diastereoisómeros de la L-isoleucina. La forma predominante en las proteínas es la L-isoleucina.
La fórmula molecular de la isoleucina es C6H13NO2 y su nombre químico es ácido α-amino-β-metil-β-etilpropiónico o ácido 2-amino-3-metil pentatónico.
La isoleucina tiene múltiples funciones fisiológicas en los animales entre las que se incluyen la
– Cicatrización de las heridas
– Desintoxicación de desechos nitrogenados
– Estimulación de las funciones inmunológicas y
– Promoción de la secreción de diferentes hormonas.
Es considerada como un aminoácido glucogénico, pues sirve de molécula precursora para la síntesis de intermediarios del ciclo de ácidos cítricos (ciclo de Krebs) que posteriormente contribuyen a la formación de glucosa en el hígado.
Por esta razón se cree que la isoleucina participa en la regulación de los niveles plasmáticos de glucosa, lo que tiene importantes implicaciones desde el punto de vista energético corporal.
La isoleucina contribuye en las rutas de síntesis de la glutamina y la alanina, trabajando a favor del balance entre los aminoácidos de cadena ramificada.
En el ámbito clínico, algunos autores señalan que un incremento en las concentraciones de isoleucina, leucina, tirosina y valina pueden ser marcadores característicos de células afectadas por tumores, seguido de un incremento en los niveles de glutamina.
Diferentes investigaciones científicas han demostrado que la isoleucina es necesaria para la síntesis de la hemoglobina, la proteína que se encarga de transportar el oxígeno en la sangre de muchos animales.
Además, este aminoácido activa la entrada de nutrientes hacia las células; algunos estudios revelan que durante el ayuno prolongado es capaz de reemplazar a la glucosa como fuente de energía y, además, es un aminoácido cetogénico.
Los aminoácidos cetogénicos son aquellos cuyos esqueletos de carbono pueden ser almacenados como ácidos grasos o carbohidratos, por lo que funcionan en la reserva de energía.
La isoleucina y los demás aminoácidos de cadena ramificada (además de factores de crecimiento y condiciones ambientales) trabajan en la activación de la ruta de señalización del blanco o diana de Rapamicina, mTOR (del inglés mechanistic Target of Rapamycin).
Esta ruta es una importante vía de señalización en los eucariotas capaz de controlar el crecimiento y el metabolismo celular, así como la síntesis proteica y los eventos de autofagia. Además, controla el progreso del envejecimiento y algunas patologías como el cáncer o la diabetes.
Los humanos y otros animales son incapaces de sintetizar isoleucina, pero esta es parte de las proteínas celulares gracias a su adquisición a partir de los alimentos que consumimos a diario.
Las plantas, los hongos y la mayoría de los microorganismos son capaces de sintetizar este aminoácido a partir de rutas un tanto complejas que, por lo general, están interconectadas con las de otros aminoácidos también considerados esenciales para el hombre.
Existen, por ejemplo, vías para la producción de isoleucina, lisina, metionina y treonina a partir del aspartato.
En las bacterias, específicamente, la isoleucina es producida a partir del aminoácido treonina, por medio del piruvato, a través de una ruta que implica la condensación de 2 de los carbonos del piruvato con una molécula de α-cetobutirato que deriva de la treonina.
La reacción comienza con la acción de la enzima treonina deshidratasa, que cataliza la deshidratación de la treonina para producir α-cetobutirato y amonio (NH3). Posteriormente, las mismas enzimas que participan en la biosíntesis de la valina contribuyen a los pasos de
– Transaminación
– Descarboxilación oxidativa de los cetoácidos correspondientes y
– Deshidrogenación.
En este tipo de microorganismos, la síntesis de aminoácidos como la lisina, la metionina, la treonina y la isoleucina está muy coordinada y regulada, especialmente por retroalimentación negativa, donde los productos de las reacciones inhiben la actividad de las enzimas involucradas.
A pesar de que la isoleucina, al igual que la leucina y la valina, son aminoácidos esenciales para el hombre, las enzimas aminotransferasas presentes en los tejidos corporales pueden inter-convertirlos reversiblemente a sus α-cetoácidos correspondientes, que pueden, eventualmente, reemplazarlos en la dieta.
Como gran parte de los aminoácidos que se conocen en la naturaleza, la isoleucina puede ser degradada para formar intermediarios de diferentes rutas metabólicas, entre las que destacan el ciclo de Krebs (que proporciona la mayor cantidad de coenzimas que funcionan para la producción de energía o para la biosíntesis de otros compuestos).
Tanto la isoleucina como el triptófano, la lisina, la fenilalanina, la tirosina, la treonina y la leucina pueden ser utilizados para producir acetil-CoA, un intermediario metabólico clave para múltiples reacciones celulares.
A diferencia de otros aminoácidos, los aminoácidos de cadena ramificada (leucina, isoleucina y valina) no son degradados en el hígado, sino que son oxidados como combustibles en el músculo, el cerebro, los riñones y en el tejido adiposo.
Dichos órganos y tejidos pueden emplear a estos aminoácidos gracias a la presencia de una enzima aminotransferasa capaz de actuar sobre los tres y producir sus α-ceto aminoácidos correspondientes.
Una vez producidos estos derivados aminoacídicos oxidados, el complejo enzimático α-cetoácido deshidrogenasa cataliza la descarboxilación oxidativa de los mismos, donde libera una molécula de dióxido de carbono (CO2) y produce un derivado acil-CoA de los aminoácidos en cuestión.
Defectos en el metabolismo de la isoleucina y otros aminoácidos pueden causar diversidad de extrañas y complejas patologías como, por ejemplo, la enfermedad “Maple Syrup Urine” (orina con olor a jarabe de arce) o Cetoaciduria de cadena ramificada.
Como su nombre lo indica, esta enfermedad se caracteriza por el distintivo aroma de la orina de los pacientes que la padecen, además de vómitos, convulsiones, retraso mental y muerte prematura.
Tiene que ver, específicamente, con errores en el complejo enzimático α-cetoácido deshidrogenasa, con lo que los aminoácidos de cadena ramificada como la isoleucina y sus derivados oxidados son excretados en la orina.
En conjunto, las patologías relacionadas con el catabolismo de aminoácidos de cadena ramificada como la isoleucina son conocidas como acidurias orgánicas, aunque las que se relacionan directamente con este aminoácido son bastante raras.
Este aminoácido es abundante en los tejidos musculares de los animales, por lo que las carnes de origen animal como la de vaca, la de cerdo, la de pescado y otras similares como el cordero, el pollo, el pavo, el venado, entre otras, son ricas en el mismo.
También se encuentra en los lácteos y sus derivados como el queso. Está en los huevos y también en diferentes tipos de semillas y nueces, como parte esencial de las proteínas que las constituyen.
Es abundante en los granos de soya y en los guisantes, así como en los extractos de levaduras empleados con diversos propósitos alimenticios.
Los niveles plasmáticos de isoleucina para un ser humano adulto están entre 30 y 108 μmol/l, para niños y jóvenes entre los 2 y los 18 años de edad está entre 22 y 107 μmol/l y para infantes entre 0 y 2 años se encuentran aproximadamente entre 26 y 86 μmol/l.
Estos datos sugieren que el consumo de alimentos ricos en este y otros aminoácidos relacionados es necesario para el mantenimiento de muchas de las funciones fisiológicas del organismo, dado que los seres humanos somos incapaces de sintetizarlo de novo.
Los suplementos nutricionales con isoleucina por lo general contienen otros aminoácidos esenciales de cadena ramificada como la valina o la leucina u otros.
Entre los ejemplos más comunes de consumo de isoleucina están los suplementos nutricionales utilizados por los deportistas para aumentar el porcentaje de masa muscular o la síntesis proteica. Sin embargo, las bases científicas sobre las cuales se soportan dichas prácticas son constantemente debatidas, y sus resultados no son completamente garantizados.
La isoleucina, sin embargo, es empleada para contraatacar los efectos metabólicos de la deficiencia vitamínica (pelagra) característica de los pacientes que tienen dietas ricas en sorgo y maíz, que son alimentos con altos contenidos de leucina, que puede afectar el metabolismo del triptófano y del ácido nicotínico en los humanos.
Los efectos de la pelagra en ratas experimentales, por ejemplo, implican retrasos en el crecimiento, que son superados con la suplementación con isoleucina.
En el área de la producción animal, aminoácidos como la lisina, la treonina, la metionina y la isoleucina han sido empleados en pruebas piloto para la alimentación de cerdos creciendo en condiciones controladas.
La isoleucina, en particular, parece tener efectos en la asimilación de nitrógeno, a pesar de que no contribuye en la ganancia de peso de estos animales de granja.
Algunas publicaciones sugieren que la isoleucina es capaz de disminuir los niveles de glucosa plasmática, por lo que su ingesta es recomendable en pacientes que padecen de trastornos como la diabetes o bajas tasas de producción de insulina.
Infecciones virales
La suplementación con isoleucina ha probado ser útil en pacientes infectados con rotavirus que ocasionan enfermedades como la gastroenteritis y la diarrea en niños pequeños y otros animales de corta edad.
Estudios recientes concluyen que el consumo de este aminoácido por animales experimentales con las características mencionadas (infectados con rotavirus) ayuda en el crecimiento y en el desempeño del sistema inmune innato gracias a la activación de las rutas de señalización PRR o de los receptores con reconocimiento de patrones.
La deficiencia el isoleucina puede acarrear problemas en la visión, en la piel (como la dermatitis) y en los intestinos (evidente como diarreas y otras manifestaciones gastrointestinales).
En vista de que es un aminoácido esencial para la formación y la síntesis de la hemoglobina, así como para la regeneración de los eritrocitos (células sanguíneas), las deficiencias severas en isoleucina pueden tener serias consecuencias fisiológicas, especialmente relacionadas con anemias y otras enfermedades hematológicas.
Esto ha sido demostrado experimentalmente en roedores “normales” a los cuales se les han proporcionado dietas pobres en este isoleucina, lo que termina con el desarrollo de cuadros anémicos importantes.
No obstante, la isoleucina participa en la formación de la hemoglobina solo en los infantes, pues la proteína del ser humano adulto no posee cantidades importantes de tal aminoácido; ello significa que la carencia de isoleucina es más evidente durante los primeros estadios del desarrollo.
- Aders Plimmer, R. (1908). The Chemical Constitution of The Proteins. Part I. London, UK: Longmans, Green, and CO.
- Aders Plimmer, R. (1908). The Chemical Constitution of The Proteins. Part II. London, UK: Longmans, Green, and CO.
- Barret, G., & Elmore, D. (2004). Amino Acids and Peptides. Cambridge: Cambridge University Press.
- Blau, N., Duran, M., Blaskovics, M., & Gibson, K. (1996). Physician’s Guide to the Laboratory Diagnosis of Metabolic Diseases (2nd ed.).
- Bradford, H. (1931). The History of the Discovery of the Amino Acids. II. A Review of Amino Acids Described Since 1931 as Components of Native Proteins. Advances in Protein Chemistry, 81–171.
- Campos-Ferraz, P. L., Bozza, T., Nicastro, H., & Lancha, A. H. (2013). Distinct effects of leucine or a mixture of the branched-chain amino acids (leucine, isoleucine, and valine) supplementation on resistance to fatigue, and muscle and liver-glycogen degradation, in trained rats. Nutrition, 29(11–12), 1388–1394.
- Champe, P., & Harvey, R. (2003). Amino Acids Amino Acids. In Lippincott’s Illustrated Reviews: Biochemistry (3rth ed., pp. 1–12). Lippincott.
- Chandran, K., & Damodaran, M. (1951). Amino-acids and Proteins in Haemoglobin Formation 2. Isoleucine. Biochemical Journal, 49, 393–398.
- Chung, A. S., & Beames, R. M. (1974). Lysine, Threonine, Methionine and Isoleucine Supplementation of Peace River Barley for Growing Pigs. Can. J. Anim. Sci., 436, 429–436.
- Dejong, C., Meijerink, W., van Berlo, C., Deutz, N., & Soeters, P. (1996). Decreased plasma isoleucine concentrations after upper gastrointestinal haemorrhage in humans. Gut, 39, 13–17.
- Edsall, J. (1960). Amino Acids, Proteins and Cancer Biochemistry (Vol. 241). London: Academic Press, Inc.
- Encyclopaedia Britannica. (2012). Retrieved August 30, 2019, from https://www.britannica.com/science/isoleucine
- Gelfand, R., Hendler, R., & Sherwin, R. (1979). Dietary Carbohydrate and Metabolism of Ingested Protein. The Lancet, 65–68.
- Hudson, B. (1992). Biochemistry of food proteins. Springer-Science+Business Media, B.V.
- Knerr, I., Vockley, J., & Gibson, K. M. (2014). Disorders of Leucine, Isoleucine, and Valine Metabolism. In N. Blau (Ed.), Physician’s Guide to the Diagnosis, Treatment, and Follow-Up of Inherited Metabolic Diseases (pp. 103–141).
- Korman, S. H. (2006). Inborn errors of isoleucine degradation: A review. Molecular Genetics and Metabolism, 89(4), 289–299.
- Krishnaswamy, K., & Gopalan, C. (1971). Effect of Isoleucine on Skin and Electroencephalogram in Pellagra. The Lancet, 1167–1169.
- Martin, R. E., & Kirk, K. (2007). Transport of the essential nutrient isoleucine in human erythrocytes infected with the malaria parasite Plasmodium falciparum. Blood, 109(5), 2217–2224.
- National Center for Biotechnology Information. PubChem Database. l-Isoleucine, CID=6306, https://pubchem.ncbi.nlm.nih.gov/compound/l-Isoleucine (accessed on Aug. 31, 2019)
- Nuttall, F. Q., Schweim, K., & Gannon, M. C. (2008). Effect of orally administered isoleucine with and without glucose on insulin, glucagon and glucose concentrations in non-diabetic subjects. The European E-Journal of Clinical Nutrition and Metabolism, 3(4), 152–158.
- van Berlo, C. L. H., van de Bogaard, A. E. J. M., van der Heijden, M. A. H., van Eijk, H. M. H., Janssen, M. A., Bost, M. C. F., & Soeters, P. B. (1989). Is increased ammonia liberation after bleeding in the digestive tract the consequence of complete absence of isoleucine in hemoglobin? A study in pigs. Hepatology, 10(3), 315–323.
- Vickery, H. B., & Schmidt, C. L. A. (1931). The history of the discovery of the amino acids. Chemical Reviews, 9(2), 169–318.
- Wolfe, R. R. (2017). Branched-chain amino acids and muscle protein synthesis in humans: myth or reality? Journal of the International Society of Sports Nutrition, 14(1), 1–7.
- Wu, G. (2009). Amino acids: Metabolism, functions, and nutrition. Amino Acids, 37(1), 1–17.
