Óxido de fósforo (v): estructura, propiedades, obtención, usos, riesgos
El óxido de fósforo (v) es un sólido inorgánico formado por fósforo (P) y oxígeno (O). Su fórmula empírica es P2O5, mientras que su fórmula molecular correcta es P4O10. Es un sólido blanco muy higroscópico, es decir, puede absorber agua del aire muy fácilmente, reaccionando de inmediato con esta. La reacción puede ser peligrosa pues ocasiona un aumento rápido de la temperatura.
Su alta tendencia a absorber agua ha hecho que se utilice como agente secante en los laboratorios químicos, así como deshidratante de algunos compuestos, esto es, para eliminar agua de sus moléculas.

El óxido de fósforo (v) es utilizado también para acelerar las reacciones de unión de moléculas de diversos hidrocarburos, siendo una reacción denominada condensación. Además, permite convertir ciertos ácidos orgánicos en ésteres.
Se ha utilizado por ejemplo para refinar gasolina, para preparar ácido fosfórico H3PO4, para obtener compuestos que sirven para retardar el fuego, para fabricar vidrios para aplicaciones de vacío, entre muchos otros usos.
El óxido de fósforo (v) debe mantenerse en recipientes bien cerrados para evitar que entre en contacto con la humedad del aire. Es corrosivo y puede hacer daño en ojos, piel y mucosas.
Índice del artículo
El óxido de fósforo (v) está formado por fósforo (P) y oxígeno (O), donde el fósforo posee valencia de +5 y el oxígeno -2. La molécula de óxido de fósforo (v) posee cuatro átomos de fósforo y diez de oxígeno y es por ello que su fórmula molecular correcta es P4O10.
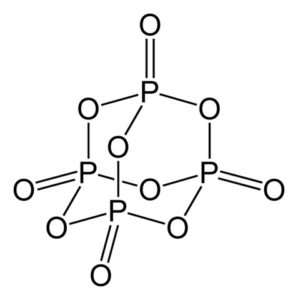
Existe en tres formas cristalinas, como polvo amorfo y en una forma vítrea (como vidrio). En la forma cristalina hexagonal cada uno de los átomos de fósforo se encuentra en los vértices de un tetraedro.
– Óxido de fósforo (v)
– Pentóxido de fósforo
– Pentóxido de difósforo
– Pentóxido fosfórico
– Anhídrido fosfórico
– Decaóxido de tetrafósforo
Sólido blanco cristalino. La forma más común es la de cristales hexagonales.
283,89 g/mol
562 ºC
360 ºC a 1 atmósfera de presión. Significa que a esta temperatura pasa de sólido a gas sin pasar por el estado líquido.
2,30 g/cm3
Muy soluble en agua. Soluble en ácido sulfúrico. Insoluble en acetona y amoníaco.
El óxido de fósforo (v) absorbe y reacciona con el agua del aire con extremada rapidez formando ácido fosfórico H3PO4. Esta reacción es exotérmica, lo que significa que se produce calor durante la misma.
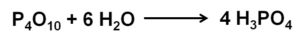
La reacción del P4O10 con agua conduce a la formación de una mezcla de ácidos fosfóricos cuya composición depende de la cantidad de agua y de las condiciones.
La reacción con los alcoholes conduce a la formación de ésteres del ácido fosfórico o de ácidos poliméricos dependiendo de las condiciones experimentales.
P4O10 + 6 ROH → 2 (RO)2PO.OH + 2 RO.PO(OH)2
Con óxidos básicos forma fosfatos sólidos.
Es corrosivo. Puede reaccionar de forma peligrosa con ácido fórmico y con bases inorgánicas como el hidróxido de sodio (NaOH), el óxido de calcio (CaO) o el carbonato de sodio Na2CO3.
Si se vierte una solución de ácido perclórico HClO4 y cloroformo CHCl3 en óxido de fósforo (v) P4O10 ocurre una explosión violenta.
No es inflamable. No favorece la combustión. Sin embargo, su reacción con agua es tan violenta y exotérmica que puede haber riesgo de incendio.
Se puede preparar mediante la oxidación directa de fósforo en una corriente de aire seco. El fósforo cuando entra en contacto con exceso de oxígeno se oxida formando el óxido de fósforo (v).
P4 + 5 O2 → P4O10
El óxido de fósforo (v) se encuentra en minerales como la ilmenita, el rutilo y el zircón.
La ilmenita es un mineral que contiene hierro y titanio y en ocasiones posee óxido de fósforo (v) en concentraciones que varían entre 0,04 y 0,33% en peso. El rutilo es un mineral de óxido de titanio y puede contener alrededor de 0,02% en peso de P2O5.
Las arenas de zircón (un mineral del elemento circonio) poseen óxido de fósforo (v) en 0,05-0,39% en peso.
Debido a su gran avidez por el agua es uno de los mejores agentes deshidratantes conocido y muy efectivo a temperaturas menores a 100 °C.
Puede extraer el agua de sustancias que de por sí son consideradas agentes deshidratantes. Por ejemplo, puede eliminar el agua del ácido sulfúrico H2SO4 convirtiéndolo en SO3 y del ácido nítrico HNO3 convirtiéndolo en N2O5.

Básicamente puede secar todos aquellos líquidos y gases con los cuales no reacciona, por lo que permite remover trazas de humedad de sistemas de vacío.
El óxido de fósforo (v) sirve para cerrar anillos de compuestos orgánicos y otras reacciones de condensación.
Permite esterificar ácidos orgánicos con la posibilidad de distinguir entre ácidos carboxílicos alifáticos primarios (cadena carbonada sin anillos con el grupo –COOH en un extremo) y ácidos aromáticos (grupo –COOH unido al anillo bencénico), pues estos últimos no reaccionan.
También sirve para eliminar una molécula de H2O de las amidas R(C=O)NH2 y las convierte en nitrilos R-CN. Además, cataliza o acelera reacciones de oxigenación, deshidrogenación y polimerización del bitumen.

Desde la década de los años 30 del siglo XX, ciertos estudios indicaron que el óxido de fósforo (v) ejercía una acción de refinación de la gasolina, aumentando su octanaje.
La acción refinadora del P4O10 se debe principalmente a reacciones de condensación (unión de moléculas diferentes) y no de polimerización (unión de moléculas iguales).
El P4O10 acelera la alquilación directa de hidrocarburos aromáticos con olefinas, la conversión de olefinas en naftenos y su polimerización parcial. La reacción de alquilación aumenta el número de octano de la gasolina.
De esta forma se obtiene una gasolina refinada de alta calidad.

El óxido de fósforo (v) sirve para:
– Preparar ácido fosfórico H3PO4
– Obtener ésteres de acrilato y surfactantes
– Preparar ésteres de fosfato que se usan como retardadores de llama, solventes y diluyentes
– Conversión de tricloruro de fósforo a oxicloruro de fósforo
– Reactivo de laboratorio
– Fabricar vidrios especiales para tubos de vacío
– Aumentar el punto de fusión del asfalto
– Servir como molécula estándar en la determinación de fósforo o fosfatos en roca fosfática, fertilizantes y cemento Portland, en forma de P2O5
– Mejorar los enlaces entre ciertos polímeros y la capa de marfil que poseen los dientes

El óxido de fósforo (v) debe mantenerse en contenedores sellados y en lugares frescos, secos y bien ventilados.
Esto sirve para prevenir que no entre en contacto con el agua, pues puede reaccionar de forma violenta con esta, generando mucho calor, hasta el punto de quemar materiales cercanos que sean combustibles.
El polvo de óxido de fósforo (v) es irritante para los ojos y tracto respiratorio y corrosivo para la piel. Puede producir quemaduras en los ojos. Por ingestión causa quemaduras internas fatales.
- U.S. National Library of Medicine. (2019). Phosphoric anhydride. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Nayler, P. (2001). Bitumens: Modified. Chemical Modification. In Encyclopedia of Materials: Science and Technology. Recuperado de sciencedirect.com.
- Malishev, B.W. (1936). Phosphorus Pentoxide as a Refining Agent for Gasoline. Industrial & Engineering Chemistry 1936, 28, 2, 190-193. Recuperado de pubs.acs.org.
- Epps, Jr. E.A. (1950). Photometric Determination of Available Phosphorus Pentoxide in Fertlizers. Analytical Chemistry 1950, 22, 8, 1062-1063. Recuperado de pubs.acs.org.
- Banerjee, A. et al. (1983). Use of Phosphorus Pentoxide: Esterification of Organic Acids. J. Org. Chem. 1983, 48, 3108-3109. Recuperado de pubs.acs.org.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Fourth Edition. John Wiley & Sons.
- Ogliari, F.A. et al. (2008). Synthesis of phosphate monomers and bonding to dentin: Esterification methods and use of phosphorus pentoxide. Journal of Dentistry, Volume 36, Issue 3, March 2008, pages 171-177. Recuperado de sciencedirect.com.
