Ácido tricloroacético: Estructura, propiedades, síntesis, usos, efectos
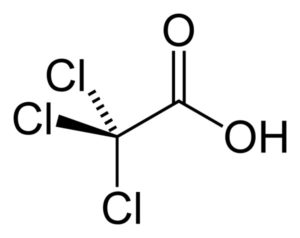
El ácido tricloroacético es un compuesto orgánico sólido cuya fórmula química es C2HCl3O2 o CCl3-COOH. Se le conoce también como ácido tricloroetanoico y como TCA. Es un ácido monocarboxílico en el cual los hidrógenos del segundo átomo de carbono han sido sustituidos por cloro. Sus cristales son incoloros a blancos.
El TCA es muy soluble en agua, generando soluciones muy ácidas. Puede precipitar las proteínas de una solución acuosa. El contacto prolongado con el ácido tricloroacético puede generar quemaduras en la piel.

Sin embargo, esto ha sido usado de manera ventajosa para tratar desórdenes de la piel, pues se usa en solución diluida y de forma muy bien controlada. También se usa a menudo el TCA en el denominado peeling químico para el rejuvenecimiento de la piel.
Por otra parte por ser un compuesto organoclorado que se encuentra en el ambiente en pequeñas proporciones ha sido responsabilizado como posible causante de daños en los bosques.
A pesar de su contenido de elemento cloro, no se tienen datos que confirmen si el ácido tricloroacético es o no carcinógeno.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades
- 4 Síntesis
- 5 Uso en el análisis de proteínas
- 6 Usos terapéuticos
- 7 Uso en tratamientos dermatológicos
- 8 Efecto de la contaminación por TCA
- 9 Referencias
El ácido tricloroacético es un ácido monocarboxílico, esto es, que contiene un solo grupo –COOH. Su esqueleto contiene solo 2 átomos de carbono. Es semejante al ácido acético CH3-COOH pero en lugar del grupo metilo –CH3, posee un grupo –CCl3, es decir, su fórmula es CCl3-COOH.
– Ácido tricloroacético
– Ácido tricloroetanoico
– Ácido 2,2,2-tricloroacético
– TCA (siglas del inglés TriChloroacetic Acid)
Sólido cristalino incoloro a blanco. Sus cristales son romboédricos
163,38 g/mol
57,5 ºC
195,5 ºC
1,6 g/cm3
Muy buena solubilidad en agua: 120 g/100 mL a 25 ºC.
Soluble en etanol CH3CH2OH y en éter dietílico CH3CH2OCH2CH3. Ligeramente soluble en tetracloruro de carbono CCl4.
El pH de una solución acuosa con 0,1 moles/L es de 1,2.
pKa = 0,51 (significa que es un ácido más fuerte que el ácido acético)
El ácido tricloroacético es un sólido higroscópico, absorbe humedad del aire formando un líquido viscoso. Tiene olor acre o picante.
Cuando se disuelve en agua ocurre la liberación de calor. Es corrosivo hacia los metales como hierro, cinc y aluminio, y hacia los tejidos biológicos. Es extremadamente corrosivo para la piel humana en contacto prolongado.
Tiene la propiedad de precipitar las proteínas en solución.
Cuando se calienta con álcalis hasta la descomposición emite humos tóxicos de cloroformo CH3Cl, ácido clorhídrico HCl, dióxido de carbono CO2 y monóxido de carbono CO.
En las fuentes consultadas no hay consenso acerca de si es o no cancerígeno.
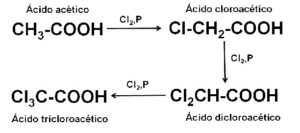
Se prepara a nivel industrial mediante la cloración del ácido acético CH3-COOH, con cloro Cl2 en presencia o no de catalizadores.
El ácido tricloroacético es ampliamente usado para la determinación de proteínas, como por ejemplo la albúmina. Es un agente muy efectivo para su precipitación, especialmente de soluciones diluidas de proteínas.
La precipitación ocurre de forma específica y cuantitativa, lo que permite separarlas de otras sustancias no-proteínicas, como polisacáridos, cationes unidos a las proteínas y sales, y permite desnaturalizar proteasas (enzimas que permiten romper las proteínas).
Según la literatura consultada no se sabe mucho acerca de cuál es el mecanismo de precipitación. Se ha sugerido que la forma dominante podría ser la de agregación hidrofóbica, puesto que hay un intervalo, alrededor del 15% de ácido trifluoroacético, en el cual ocurre la precipitación óptima.
Se han empleado con éxito soluciones diluidas de TCA en el tratamiento de la otitis aguda externa (dolor de oído en la zona anterior al tímpano o canal auditivo externo).
El TCA desactiva las células inflamatorias cambiando sus propiedades, secando la región inflamada, reduciendo el edema y aliviando rápidamente el dolor. Además es tolerado muy bien por los pacientes, tanto niños como adultos.
Adicionalmente, restablece el estado acídico de la zona, inhibiendo la proliferación de bacterias y hongos en la fase aguda de la enfermedad. Su mecanismo de acción previene la recurrencia y progresión de la enfermedad a fase crónica.
Se ha empleado en el tratamiento de la queratosis actínica, la cual es una enfermedad de la piel que se caracteriza por una zona escamosa que se forma en áreas de la piel expuestas de forma crónica durante años a la radiación UV, como la cara, cuero cabelludo o los antebrazos.
Un pequeño porcentaje de esta enfermedad conduce a cáncer de piel, de ahí la importancia de tratarla a tiempo.
También se usa para la rosácea, dermatitis seborreica, acné, xantelasmas (pequeñas protuberancias benignas de grasa), verrugas, lunares e hiperpigmentación.
El procedimiento se denomina quemi-exfoliación o peeling químico y el ácido tricoloacético se prefiere sobre otros compuestos químicos por su seguridad, efectividad y no-toxicidad sistémica.
El TCA destruye químicamente la epidermis y la dermis superior de la zona tratada. La nueva epidermis migra desde los anexos cutáneos debajo del tejido destruido, después de lo cual la corteza suprayacente se desprende en pocos días.
La regeneración dérmica es evidente en 2 a 3 semanas. Los cambios histológicos en la piel son la homogeneización de la arquitectura del colágeno y un aumento en el tejido elástico en la dermis.
Estos cambios son permanentes. Además, las células anómalas son removidas y reemplazadas por células normales epidérmicas.
La quemi-exfoliación o peeling con ácido tricloroacético también se emplea en el tratamiento cosmético de piel envejecida, arrugada, pecas, cicatrices de acné y tatuajes.

Puede producir un quemado cutáneo relativamente profundo sin producir toxicidad sistémica. Los tratamientos deben ser realizados siempre por personal capacitado y con experiencia.
Las variables a tomar en cuenta para el éxito de la técnica son la concentración adecuada del ácido según el tipo y grosor de la piel, la técnica de aplicación, la efectividad de la preparación previa de la piel, densidad y actividad de las glándulas sebáceas y aplicación de agentes queratolíticos antes del tratamiento.
Cada paciente debe ser evaluado para seleccionar la concentración adecuada y evitar resultados desastrosos.
El ácido tricloroacético es un compuesto químico presente en el aire, la lluvia, vegetación y suelo. Por esta razón ha sido implicado como responsable de efectos adversos sobre algunos bosques y selvas.

Hay incertidumbre en cuanto a las fuentes del TCA en el ambiente. Aunque hay consenso en que puede provenir de la oxidación de solventes clorados presentes en la atmósfera, las concentraciones de TCA encontradas en las precipitaciones son mucho mayores de lo que cabría esperar si fuese de tales solventes.
El TCA también puede producirse en el suelo y degradarse en este. Las plantas pueden tomar el TCA tanto del aire como del suelo y ser transportado de las hojas a la raíz y viceversa. Se estima que sea metabolizado en el follaje.
En pruebas realizadas por algunos investigadores en plántulas de un tipo de pino tratadas con niveles de ácido tricloroacético similares a los encontrados en el aire en algunas zonas de Europa, EEUU y Canadá, se encontró que no se producen daños visibles a las plantas ni cambios en el crecimiento de estas por causa del TCA.
Solo se encontró cierta disminución en el contenido de proteínas de las plantas tratadas con TCA, hecho posiblemente debido a la propiedad del ácido tricloroacético de precipitar las proteínas.
- Novák, P. and Havlícek, V. (2016). Protein Extraction and Precipitation. In Proteomic Profiling and Analytical Chemistry (Second Edition). Recuperado de sciencedirect.com.
- U.S. National Library of Medicine. (2019). Trichloroacetic acid. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Cape, N.J. et al. (2003). Long-Term Exposure of Sitka Spruce Seedlings to Trichloroacetic Acid. Environ. Sci. Technol. 2003, 37, 2953-2957. Recuperado de pubs.acs.org.
- Brodland, D.G. et al. (1988). Trichloroacetic Acid Chemexfoliation (Chemical Peel) for Extensive Premalignant Actinic Damage of the Face and Scalp. Mayo Clin Proc 63:887-896, 1988. Recuperado de ncbi.nlm.nih.gov.
- Collins, P.S. (1989). Trichloroacetic Acid Peels Revisited. Dermatol. Surg. Oncol. 1989; 15:933-940. Recuperado de onlinelibrary.wiley.com.
- Kantas, I. et al. (2007). The use of trichloroacetic acid in the treatment of acute external otitis. Eur Arch Otorhinolaryngol (2007) 264:9-14. Recuperado de ncbi.clm.nih.gov.
