Yodato de potasio: propiedades, estructura, usos, riesgos
¿Qué es el yodato de potasio?
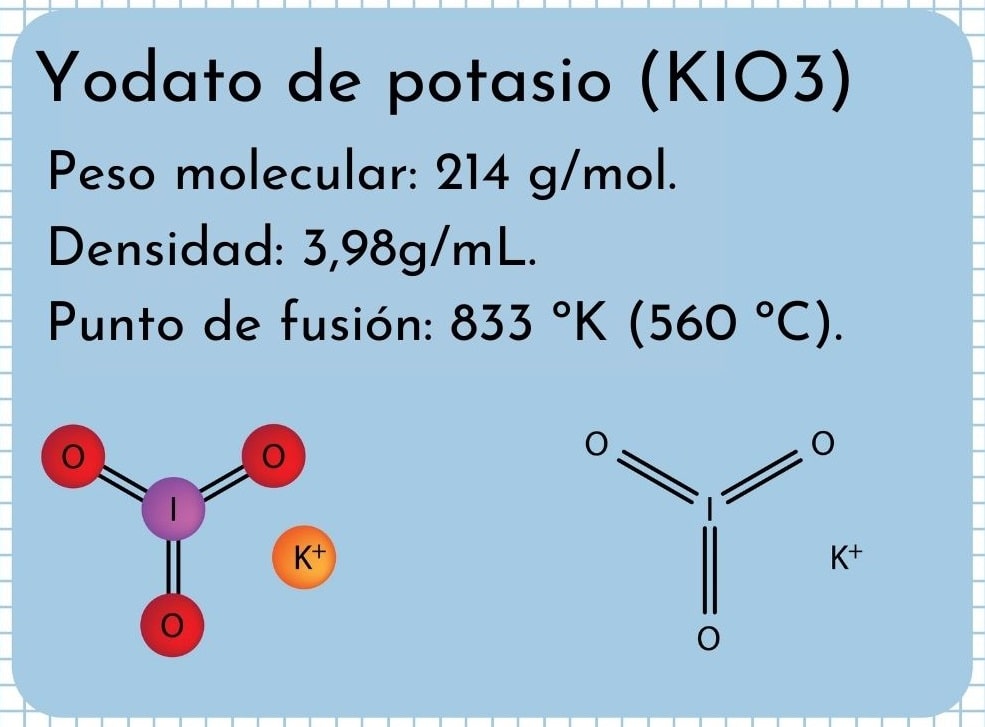
El yodato de potasio o yodato potásico es un compuesto inorgánico de yodo, específicamente una sal, cuya fórmula química es KIO3. El yodo o iodo, elemento del grupo de los halógenos (F, Cl, Br, I, As), tiene en esta sal un número de oxidación de +5; por esto es un fuerte agente oxidante. El KIO3 se disocia en medio acuoso para crear los iones K+ y IO3–.
Es sintetizado haciendo reaccionar hidróxido de potasio con ácido yódico: HIO3(aq) + KOH(s) => KIO3(aq) + H2O(l). También, puede sintetizarse al hacer reaccionar el yodo molecular con hidróxido de potasio: 3I2(s) + 6KOH(s) => KIO3(aq) + 5KI(aq) + 3H2O(l).
Propiedades del yodato de potasio

Es un sólido blanco inodoro, de cristales finos y con una estructura cristalina de tipo monoclínica. Tiene una densidad de 3,98g/mL, un peso molecular de 214 g/mol y presenta bandas de absorción en el espectro infrarrojo (IR).
Tiene un punto de fusión: 833 ºK (560 ºC), consistente con las fuertes interacciones iónicas entre los iones K+ y IO3–. A temperaturas mayores sufre una reacción de descomposición térmica, liberando oxígeno molecular y yoduro de potasio:
2KIO3(s) => 2KI(s) + 3O2(g)
En agua tiene solubilidades que varían de 4,74g/100mL a 0 ºC, hasta 32,3 g/100mL a 100 ºC, generando soluciones acuosas incoloras. Además, es insoluble en alcohol y ácido nítrico, pero es soluble en ácido sulfúrico diluido.
Su afinidad por el agua no es apreciable, lo que explica por qué no es higroscópico y tampoco existe en forma de sales hidratadas (KIO3·H2O).
Agente oxidante
El yodato de potasio, tal como indica su fórmula química, posee tres átomos de oxígeno. Este es un elemento fuertemente electronegativo y, debido a esta propiedad, deja “descubierta” una deficiencia electrónica en la nube que rodea al yodo.
Esta deficiencia —o aporte, según sea el caso— puede calcularse como el número de oxidación del yodo (±1, +2, +3, +5, +7), siendo +5 para el caso de esta sal.
¿Qué significa esto? Que ante una especie capaz de ceder sus electrones, el yodo los aceptará en su forma iónica (IO3–) para convertirse en yodo molecular y tener un número de oxidación igual a 0.
A raíz de esta explicación se puede determinar que el yodato de potasio es un compuesto oxidante que reacciona intensamente con agentes reductores en muchas reacciones redox; de todas estas, una es conocida con el nombre de reloj de yodo.
El reloj de yodo consiste en un proceso redox de pasos lentos y rápidos, en el que los pasos rápidos son marcados por una solución KIO3 en ácido sulfúrico a la que se le añade almidón. Seguidamente, el almidón —una vez producida y anclada entre su estructura la especie I3–— tornará la solución de incolora a azul oscuro.
IO3− + 3 HSO3− → I− + 3 HSO4−
IO3− + 5 I− + 6 H+ → 3 I2 + 3 H2O
I2 + HSO3− + H2O → 2 I− + HSO4− + 2 H+ (azul oscuro por efecto del almidón)
Estructura química
En la imagen superior está ilustrada la estructura química del yodato de potasio. El anión IO3– está representado por el “trípode” de esferas rojas y moradas, mientras que los iones K+ están representados por las esferas moradas.
Pero, ¿qué significan estos trípodes? Las formas geométricas correctas de estos aniones son en realidad pirámides trigonales, en los cuales los oxígenos componen la base triangular, y el par no compartido de electrones del yodo apunta hacia arriba, ocupando espacio y obligando a doblar hacia abajo el enlace I–O y los dos enlaces I=O.
Esta geometría molecular corresponde a una hibridación sp3 del átomo central de yodo; sin embargo, otra perspectiva sugiere que uno de los átomos de oxígeno forma enlaces con los orbitales “d” del yodo, siendo en realidad una hibridación de tipo sp3d2 (el yodo puede disponer de sus orbitales “d” expandiendo su capa de valencia).
Los cristales de esta sal pueden sufrir transiciones de fase estructural (otros arreglos distintos al monoclínico) como consecuencia de las distintas condiciones físicas que los someten.
Usos y aplicaciones del yodato de potasio
Uso terapéutico
El yodato de potasio suele ser utilizado para evitar la acumulación de radiactividad en la tiroides bajo la forma de 131I, cuando este isótopo es utilizado en la determinación de la captación de yodo por la tiroides como un componente del funcionamiento de la glándula tiroidea.
Igualmente, el yodato de potasio es utilizado como antiséptico tópico (0,5 %) en las infecciones de las mucosas.
Uso en la industria
Es adicionado a los alimentos de los animales de cría como un suplemento de yodo. Por lo tanto, en la industria se usa el yodato de potasio para mejorar la calidad de las harinas.
Uso analítico
En química analítica, gracias a su estabilidad, se utiliza como patrón primario en la estandarización de soluciones patrones de tiosulfato de sodio (Na2S2O3), con el propósito de determinar las concentraciones de yodo en las muestras problemas.
Esto quiere decir que las cantidades de yodo pueden conocerse por técnicas volumétricas (titulaciones). En esta reacción el yodato de potasio oxida rápidamente a los iones yoduros I–, mediante la siguiente ecuación química:
IO3– + 5I– + 6H+ => 3I2 + 3H2O
El yodo, I2, resulta titulado con la solución de Na2S2O3 para su estandarización.
Uso en la tecnología de los láseres
Estudios han demostrado y corroborado las interesantes propiedades piezoeléctricas, piroeléctricas, electroópticas, ferroeléctricas y en la óptica no lineal de los cristales de KIO3. Esto trae como resultado grandes potenciales en el campo electrónico y en la tecnología de los láseres para materiales elaborados con este compuesto.
Riesgos para la salud del yodato de potasio
En dosis elevadas puede producir irritaciones en la mucosa oral, la piel, ojos y en las vías respiratorias.
Los experimentos de la toxicidad del yodato de potasio en animales han permitido observar que en perros en ayuna, a dosis de 0,2-0,25 g/kg de peso corporal, suministrado en forma oral, el compuesto provoca vómitos.
Si estos vómitos son evitados, produce en los animales un empeoramiento de su situación, ya que se induce una anorexia y postración previa a la muerte. Sus autopsias permitieron observar lesiones necróticas en hígado, riñones y mucosa intestinal.
Debido a su poder oxidante, representa un riesgo de incendios al entrar en contacto con materiales inflamables.
Referencias
- Day, R., & Underwood, A. Química Analítica Cuantitativa (quinta ed.). PEARSON Prentice Hall, p-364.
- ChemicalBook. (2017). Potassium iodate. Recuperado el 25 de marzo de 2018, de ChemicalBook: chemicalbook.com
- PubChem. (2018). Potassium Iodate. Recuperado el 25 de marzo de 2018, de PubChem: pubchem.ncbi.nlm.nih.gov
- Merck. (2018). Potasio yodato. Recuperado el 25 de marzo de 2018, de Merck:
- merckmillipore.com
- M M Abdel Kader et al. (2013). Charge transport mechanism and low temperatura phase transitions in KIO3. J. Phys.: Conf. Ser. 423 012036
