Cloruro de cobre (I) (CuCl): estructura, propiedades, usos
El cloruro de cobre (I) es un compuesto inorgánico formado por cobre (Cu) y cloro (Cl). Su fórmula química es CuCl. El cobre en este compuesto posee valencia de +1 y el cloro -1. Se trata de un sólido cristalino de color blanco que cuando está expuesto mucho tiempo al aire adquiere una coloración verdosa por causa de la oxidación del cobre (I) a cobre (II).
Se comporta como ácido Lewis necesitando electrones de otros compuestos que sean bases Lewis, con los cuales forma complejos o aductos estables. Uno de estos compuestos es el monóxido de carbono (CO), por lo que la capacidad de unirse entre ambos se utiliza industrialmente para extraer el CO de corrientes gaseosas.

Tiene propiedades ópticas que pueden utilizarse en semiconductores emisores de luz. Además los nanocubos de CuCl tienen un gran potencial para ser utilizados en dispositivos para almacenar energía de manera eficiente.
Es empleado en el arte de la pirotecnia pues en contacto con una llama produce una luz verde azulada.
Índice del artículo
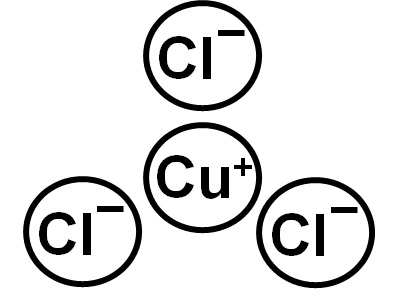
El CuCl está formado por el ion cuproso Cu+ y anión cloruro Cl–. La configuración electrónica del ion Cu+ es:
1s2 2s2 2p6 3s2 3p6 3d10 4s0
y se debe a que el cobre perdió el electrón de la capa 4s. El ion cloruro posee la configuración:
1s2 2s2 2p6 3s2 3p6
Se puede observar que ambos iones tienen sus capas electrónicas completas.
Este compuesto cristaliza con simetría cúbica. En la imagen a continuación se observa la disposición de los átomos en una unidad cristalina. Las esferas rosadas corresponden al cobre y las esferas verdes al cloro.
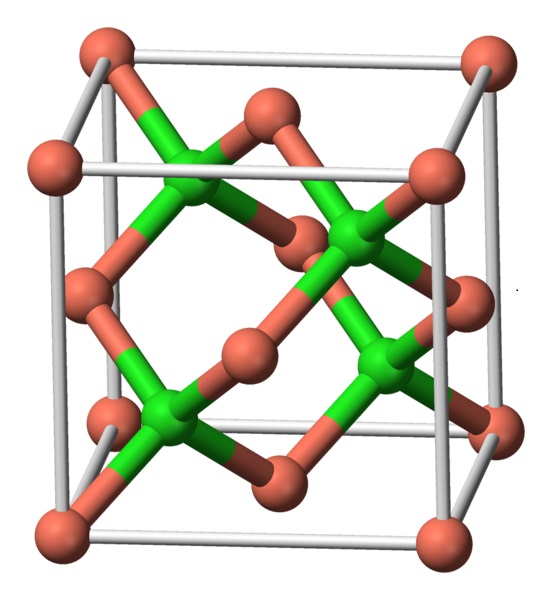
- Cloruro de cobre (I)
- Cloruro cuproso
- Monocloruro de cobre
Sólido blanco cristalino que en contacto prolongado con aire se oxida y se vuelve verde.
98,99 g/mol
430 ºC
Aproximadamente 1400 ºC.
4,137 g/cm3
Casi insoluble en agua: 0,0047 g/100 g de agua a 20 °C. Insoluble en etanol (C2H5OH) y acetona (CH3(C=O)CH3).
Es inestable al aire debido que el Cu+ tiende a oxidarse a Cu2+. Con el tiempo se va formando óxido cúprico (CuO), hidróxido cuproso (CuOH) o un oxicloruro complejo y la sal se va tornando verde.

En solución acuosa también es inestable pues ocurre una reacción de oxidación y reducción simultáneamente, formándose cobre metálico e ion cobre (II):
CuCl → Cu0 + CuCl2
Este compuesto actúa químicamente como ácido Lewis, lo que significa que está ávido de electrones, por ello forma aductos estables con compuestos que pueden proporcionarlos.
Es muy soluble en ácido clorhídrico (HCl), donde los iones Cl– se comportan como donantes de electrones y se forman especies como CuCl2–, CuCl32- y Cu2Cl42-, entre otras.
Las soluciones acuosas de CuCl tienen la capacidad de absorber el monóxido de carbono (CO). Esta absorción puede ocurrir cuando dichas soluciones son tanto ácidas, como neutras o con amoníaco (NH3).
En tales soluciones se estima que se formen diversas especies tales como Cu(CO)+, Cu(CO)3+, Cu(CO)4+, CuCl(CO) y [Cu(CO)Cl2]–, lo cual depende del medio.
Posee características electroópticas, baja pérdida óptica en un amplio intervalo del espectro de luz desde el visible hasta el infrarrojo, bajo índice de refracción y baja constante dieléctrica.
El cloruro de cobre (I) se puede obtener haciendo reaccionar directamente el metal cobre con el gas cloro a una temperatura de 450-900 °C. Esta reacción se aplica industrialmente.
2 Cu + Cl2 → 2 CuCl
También se puede utilizar un compuesto reductor como el ácido ascórbico o el dióxido de azufre para pasar el cloruro de cobre (II) a cloruro de cobre (I). Por ejemplo, en el caso del SO2, este se oxida a ácido sulfúrico.
2 CuCl2 + SO2 + 2 H2O → 2 CuCl + H2SO4 + 2 HCl
La capacidad de las soluciones de CuCl de absorber y desorber el monóxido de carbono es utilizada industrialmente para obtener CO puro.
Por ejemplo, el proceso denominado COSORB utiliza cloruro de cobre estabilizado en forma de una sal compleja con aluminio (CuAlCl4), la cual se disuelve en un solvente aromático como tolueno.
La solución absorbe el CO de una corriente gaseosa para separarlo de otros gases como CO2, N2 y CH4. Luego la solución rica en el monóxido se calienta bajo presión reducida (es decir, inferior a la atmosférica) y el CO se desorbe. El gas recuperado de esta forma es de alta pureza.
Este proceso permite obtener CO puro partiendo de gas natural reformado, carbón gasificado o gases derivados de la producción de acero.
El CuCl se emplea como catalizador de diversas reacciones químicas.
Por ejemplo, la reacción del elemento germanio (Ge) con cloruro de hidrógeno (HCl) y etileno (CH2=CH2) se puede realizar utilizando este compuesto. También sirve para la síntesis de compuestos orgánicos de silicio y diversos derivados orgánicos heterocíclicos de azufre y nitrógeno.
Se puede sintetizar un polímero de polifenileneter empleando un sistema catalítico de 4-aminopirina y CuCl. Este polímero es muy útil por sus propiedades mecánicas, poca absorción de humedad, excelente aislamiento de la electricidad y resistencia al fuego.
Se pueden preparar compuestos de alquenilcuprato haciendo reaccionar un alquino terminal con una solución acuosa de CuCl y amoníaco.
El cloruro de cobre (I) puede coordinarse con polímeros formando complejas moléculas que sirven como catalizadores y que combinan la simplicidad de un catalizador heterogéneo con la regularidad de uno homogéneo.
Se utiliza este compuesto en la obtención de un material formado por γ-CuCl sobre silicio, que posee propiedades de fotoluminiscencia con un alto potencial de ser utilizado como semiconductor emisor de fotones.
Estos materiales tienen amplio uso en diodos emisores de luz ultravioleta, diodos láser y detectores de luz.
Este producto obtenido en forma de nanopartículas cúbicas o nanocubos permite fabricar supercondensadores, pues posee una velocidad de carga sobresaliente, alta reversibilidad y pequeña pérdida de capacitancia.
Los supercondensadores son dispositivos para almacenar energía que se destacan por su alta densidad de potencia, seguridad en la operación, rápidos ciclos de carga y descarga, estabilidad a largo plazo y son ambientalmente amigables.

Dado que cuando se somete a una llama el CuCl emite luz verde azulada, se emplea para preparar fuegos artificiales donde proporciona ese color durante la ejecución de la pirotecnia.

- Milek, J.T. and Neuberger, M. (1972). Cuprous Chloride. In: Linear Electrooptic Modular Materials. Springer, Boston, MA. Recuperado de link.springer.com.
- Lide, D.R. (editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Sneeden, R.P.A. (1982). Absorption/desorption methods. In Comprehensive Organometallic Chemistry. Volume 8. Recuperado de sciencedirect.com.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Chandrashekhar, V.C. et al. (2018). Recent Advances in Direct Synthesis of Organometallic and Coordination Compounds. In Direct Synthesis of Metal Complexes. Recuperado de sciencedirect.com.
- Kyushin, S. (2016). Organosilicon Synthesis for Construction of Organosilicon Clusters. In Efficient Methods for Preparing Silicon Compounds. Recuperado de sciencedirect.com.
- Van Koten, G. and Noltes, J.G. (1982). Organocopper compounds. In Comprehensive Organometallic Chemistry. Volume 2. Recuperado de sciencedirect.com.
- Danieluk, D. et al. (2009). Optical properties of undoped and oxygen doped CuCl films on silicon substrates. J Mater Sci: Mater Electron (2009) 20: 76-80. Recuperado de link.springer.com.
- Yin, B. et al. (2014). Cuprous Chloride Nanocubes Grown on Copper Foil for Pseudocapacitor Electrodes. Nano-Micro Lett. 6, 340-346 (2014). Recuperado de link.springer.com.
- Kim, K. et al. (2018). A Highly Efficient Aromatic Amine Ligand/Copper(I) Chloride Catalyst System for the Synthesis of Poly(2,6-dimethyl-1,4-phenylene ether). Polymers 2018, 10, 350. Recuperado de mdpi.com.
- Wikipedia (2020). Copper(I) chloride. Recuperado de en.wikipedia.org.
