Glutatión: características, estructura, funciones, biosíntesis
El glutatión (GSH) es una pequeña molécula tripeptídica (con solo tres residuos aminoacídicos) no proteica que participa en muchos fenómenos biológicos como la mecánica enzimática, la biosíntesis de macromoléculas, el metabolismo intermediario, la toxicidad de oxígeno, el transporte intracelular, etc.
Este péptido de pequeño tamaño, presente en animales, en plantas y en algunas bacterias, es contemplado como un “buffer” oxido-reductor, puesto que es uno de los principales compuestos de bajo peso molecular que contiene azufre y carece de la toxicidad asociada con los residuos de cisteína.
Algunas enfermedades en humanos han sido asociadas con la deficiencia de enzimas específicas del metabolismo del glutatión, y esto se debe a sus múltiples funciones en el mantenimiento de la homeostasis corporal.
La malnutrición, el estrés oxidativo y otras patologías padecidas por los seres humanos pueden ser evidenciadas como una drástica disminución del glutatión, por lo que algunas veces es un buen indicador del estado de salud de los sistemas corporales.
Para las plantas, de igual forma, el glutatión es un factor indispensable para su crecimiento y desarrollo, ya que también cumple funciones en múltiples vías biosintéticas y es esencial para la desintoxicación celular y la homeostasis interna, donde actúa como un poderoso antioxidante.
Índice del artículo
- 1 Características
- 2 Estructura
- 3 Funciones
- 4 Biosíntesis
- 5 Beneficios de su ingesta
- 6 Efectos secundarios
- 7 Referencias
Los primeros estudios realizados en relación a la ubicación subcelular del glutatión demostraron que está presente en las mitocondrias. Posteriormente, también se observó en la región correspondiente a la matriz nuclear y en los peroxisomas.
En la actualidad se sabe que el compartimiento donde su concentración es más abundante es en el citosol, puesto que allí es producido activamente y es transportado hacia otros compartimentos celulares como la mitocondria.
En las células de mamíferos, la concentración de glutatión está en el rango de los milimoles, mientras que en el plasma sanguíneo su forma reducida (GSH) se encuentra en concentraciones micromolares.
Esta concentración intracelular se asemeja mucho a la concentración de glucosa, potasio y colesterol, elementos indispensables para la estructura, el funcionamiento y el metabolismo celulares.
Algunos organismos poseen moléculas análogas o variantes del glutatión. Parásitos protozoarios que afectan a los mamíferos poseen una forma conocida como “tripanotión” y en algunas bacterias este compuesto es reemplazado por otras moléculas sulfuradas como el tiosulfato y la glutamilcisteína.
Ciertas especies de plantas poseen, además del glutatión, unas moléculas homólogas que tienen residuos diferentes a la glicina en el extremo C-terminal (homoglutatión), y que se caracterizan por presentar funciones similares a las del tripéptido en cuestión.
A pesar de la existencia de otros compuestos similares al glutatión en diferentes organismos, este es uno de los “tioles” que se encuentra en mayor concentración intracelularmente.
La elevada relación que existe normalmente entre la forma reducida (GSH) y la forma oxidada (GSSG) del glutatión es otra característica distintiva de esta molécula.
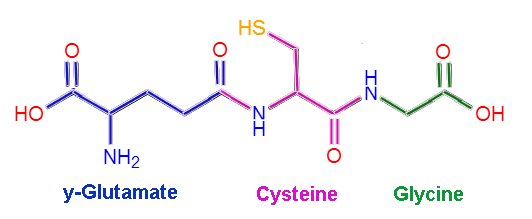
El glutatión o la L-γ-glutamil-L-cisteinil-glicina, tal y como su nombre lo indica, está compuesto por tres residuos aminoacídicos: L-glutamato, L-cisteína y glicina. Los residuos de cisteína y glicina se unen entre sí a través de enlaces peptídicos comunes, es decir, entre el grupo α-carboxilo de un aminoácido y el grupo α-amino del otro.
Sin embargo, el enlace que se da entre la glutamato y la cisteína no es típico de proteínas, puesto que ocurre entre la porción γ-carboxilo del grupo R del glutamato y el grupo α-amino de la cisteína, por lo que se este enlace se denomina enlace γ.
Esta pequeña molécula tiene una masa molar de poco más de 300 g/mol y la presencia del enlace γ parece ser crucial para la inmunidad de este péptido frente a la acción de muchas enzimas aminopeptidasas.
Como se ha comentado, el glutatión es una proteína que participa en numerosos procesos celulares de animales, plantas y determinados procariotas. En este sentido, puede destacarse su participación general en:
-Los procesos de síntesis y degradación de proteínas
-La formación de los precursores ribonucleótidos del ADN
-La regulación de la actividad de algunas enzimas
-La protección de las células en presencia de especies reactivas de oxígeno (ROS) y otros radicales libres
-La transducción de señales
-La expresión genética y en
-La apoptosis o muerte celular programada
También se ha determinado que el glutatión funciona como coenzima en muchas reacciones enzimáticas, y que parte de su importancia se relaciona con la que tiene capacidad para transportar aminoácidos en forma de γ-glutamil aminoácidos intracelularmente.
El glutatión que puede salir de la célula (que lo hace en su forma reducida) es capaz de participar en reacciones de oxido-reducción en las inmediaciones de la membrana plasmática y el medio celular circundante, lo que protege a las células de daños frente a distintas clases de agentes oxidantes.
Este tripéptido también funciona como fuente de almacenamiento de cisteína y contribuye en el mantenimiento del estado reducido de los grupos sulfhidrilo de las proteínas en el interior celular y del estado ferroso del grupo hemo de las proteínas que contienen dicho cofactor.
Cuando participa en el plegamiento de proteínas, parece tener una importante función como agente reductor de los puentes disulfuro que se han formado inapropiadamente en las estructuras proteicas, que usualmente se debe a la exposición a agentes oxidantes como el oxígeno, peróxido de hidrógeno, peroxinitrito y algunos superóxidos.
En los eritrocitos, el glutatión reducido (GSH) producido por la enzima glutatión reductasa, que emplea el NADPH producido por la vía de las pentosas fosfato, contribuye con la remoción del peróxido de hidrógeno a través de la reacción catalizada por otra enzima: la glutatión peroxidasa, que produce agua y glutatión oxidado (GSSG).
La descomposición del peróxido de hidrógeno y, por lo tanto, la prevención de su acumulación en los eritrocitos, prolonga el tiempo de vida de estas células, puesto que evita el daño oxidativo que puede darse en la membrana celular y que puede terminar en hemólisis.
El glutatión también es un protagonista importante en el metabolismo de xenobióticos, gracias a la acción de enzimas glutatión S-transferasas que generan conjugados de glutatión que luego pueden ser metabolizados intracelularmente.
Es prudente recordar que el término “xenobiótico” es empleado para hacer referencia a drogas, contaminantes ambientales y carcinógenos químicos a los que se expone un organismo.
Como el glutatión existen en dos formas, una reducida y otra oxidada, la relación entre ambas moléculas determina el estado redox de las células. Si la relación GSH/GSSG es mayor que 100, las células se consideran sanas, pero si es cercano a 1 o 10, puede ser un indicador de que las células se encuentran en un estado de estrés oxidativo.
El tripéptido glutatión es sintetizado en el interior celular, tanto de plantas como de animales, por la acción de dos enzimas: (1) la γ-glutamilcisteína sintetasa y (2) la glutatión sintetasa (GSH sintetasa), mientras que su degradación o “descomposición” depende de la acción de la enzima γ-glutamil transpeptidasa.
En los organismos vegetales, cada una de las enzimas es codificada por un solo gen y los defectos en cualquiera de las proteínas o sus genes codificantes pueden causar letalidad en los embriones.
En el ser humano, al igual que en otros mamíferos, el principal sitio de síntesis y exportación de glutatión es el hígado, concretamente en las células hepáticas (hepatocitos) que rodean los conductos venosos que transportan sangre y otras sustancias desde y hacia el órgano en cuestión.
La síntesis de novo del glutatión, su regeneración o su reciclaje, requieren de la energía proveniente del ATP para ocurrir.
El glutatión reducido deriva de los aminoácidos glicina, glutamato y cisteína, como ya se ha comentado, y su síntesis comienza con la activación (empleando ATP) del grupo γ-carboxilo del glutamato (del grupo R) para formar un intermediario acil fosfato, que es atacado por el grupo α-amino de la cisteína.
Esta primera reacción de condensación de dos aminoácidos es catalizada por la γ-glutamilcisteína sintetasa y usualmente se ve afectada por la disponibilidad intracelular de los aminoácidos glutamato y cisteína.
El dipéptido así formado es posteriormente condensado con una molécula de glicina gracias a la acción de la GSH sintetasa. Durante esta reacción también ocurre una activación con ATP del grupo α-carboxilo de la cisteína para formar un acil fosfato y favorecer así la reacción con el residuo de glicina.
Cuando el glutatión reducido participa en reacciones de óxido-reducción, la forma oxidada está conformada, en realidad, por dos moléculas de glutatión unidas entre sí a través de puentes disulfuro; es por esta razón que la forma oxidada se abrevia con las siglas “GSSG”.
La formación de la especie oxidada del glutatión depende de una enzima conocida como glutatión peroxidasa o GSH peroxidasa, que es una peroxidasa que contiene una selenocisteína (un residuo de cisteína que en vez de tener un átomo de azufre tiene uno de selenio) en su sitio activo.
La interconversión entre las formas oxidada y reducida se da gracias a la participación de una GSSG reductasa o glutatión reductasa, que emplea NAPDH para catalizar la reducción del GSSG en presencia de oxígeno, con la formación concomitante de peróxido de hidrógeno.
El glutatión puede ser administrado por vía oral, tópica, intravenosa, intranasal o nebulizado, en aras de incrementar su concentración sistémica en pacientes que padecen estrés oxidativo, por ejemplo.
Las investigaciones realizadas con respecto a la administración oral de glutatión sugieren que su ingesta puede reducir los riesgos de padecimiento de cáncer oral y que, administrado en conjunto con quimioterapéuticos oxidativos, reduce los efectos negativos de la terapia en pacientes oncológicos.
Generalmente, los pacientes infectados con el virus de inmunodeficiencia adquirida (VIH) tienen deficiencias intracelulares de glutatión tanto en los glóbulos rojos como en las células T y en los monocitos, lo que condiciona su correcto funcionamiento.
En un estudio realizado por Morris y colaboradores se demostró que el suministro de glutatión a macrófagos provenientes de pacientes VIH positivos mejoraba considerablemente la función de estas células, especialmente frente a infecciones con patógenos oportunistas como M. tuberculosis.
Otros estudios tienen que ver con el mejoramiento de la actividad contráctil de los músculos, de la defensa antioxidativa y de los daños oxidativos causados en respuesta a lesiones por isquemia/reperfusión tras la administración oral de GSH durante entrenamientos físicos de resistencia.
Se ha considerado, a su vez, que su ingesta o administración intravenosa tiene funciones en la prevención del progreso de algunos tipos de cáncer y en la reducción de los daños celulares que se dan producto de ciertas patologías hepáticas.
A pesar de que no todos los estudios reportados han sido realizados en pacientes humanos, sino que usualmente se trata de pruebas en modelos animales (generalmente murinos), los resultados obtenidos en algunos ensayos clínicos aseveran la efectividad del glutatión exógeno como antioxidante.
Por esta razón, es empleado para el tratamiento de cataratas y glaucoma, como producto “anti-edad”, para el tratamiento de la hepatitis, de numerosas enfermedades cardíacas, de la pérdida de memoria y para el fortalecimiento del sistema inmune, y para la depuración tras el envenenamiento con metales pesados y drogas.
El glutatión administrado exógenamente no puede ingresar a las células a menos de que sea hidrolizado hasta sus aminoácidos constituyentes. Por tanto, el efecto directo de la administración (oral o intravenosa) de este compuesto es el incremento de la concentración intracelular de GSH gracias al aporte de los aminoácidos necesarios para su síntesis, que sí pueden ser transportados efectivamente hacia el citosol.
A pesar de que se considera que la ingesta de glutatión es “segura” o inocua, no se han realizado suficientes estudios sobre sus efectos secundarios.
No obstante, de los pocos estudios reportados se sabe que puede tener efectos negativos que resultan de la interacción con otros fármacos y que pueden ser nocivos para la salud en diversos contextos fisiológicos.
Si se toma a largo plazo parece que actúan en la disminución excesiva los niveles de zinc y, además, si es inhalado, puede producir fuertes ataques de asma en pacientes asmáticos.
- Allen, J., & Bradley, R. (2011). Effects of Oral Glutathione Supplementation on Systemic Oxidative Stress Biomarkers in Human Volunteers. The Journal of Alternative and Complementary Medicine, 17(9), 827–833.
- Conklin, K. A. (2009). Dietary Antioxidants During Cancer Chemotherapy: Impact on Chemotherapeutic Effectiveness and Development of Side Effects. Nutrition and Cancer, 37(1), 1–18.
- Meister, A. (1988). Glutathione Metabolism and Its Selective Modification. The Journal of Biological Chemistry, 263(33), 17205–17208.
- Meister, A., & Anderson, M. E. (1983). Glutathione. Ann. Rev Biochem., 52, 711–760.
- Morris, D., Guerra, C., Khurasany, M., Guilford, F., & Saviola, B. (2013). Glutathione Supplementation Improves Macrophage Functions in HIV. Journal of Interferon & Cytokine Research, 11.
- Murray, R., Bender, D., Botham, K., Kennelly, P., Rodwell, V., & Weil, P. (2009). Harper’s Illustrated Biochemistry (28th ed.). McGraw-Hill Medical.
- Nelson, D. L., & Cox, M. M. (2009). Lehninger Principios de Bioquímica. Ediciones Omega (5th ed.). https://doi.org/10.1007/s13398-014-0173-7.2
- Noctor, G., Mhamdi, A., Chaouch, S., Han, Y. I., Neukermans, J., Marquez-garcia, B., … Foyer, C. H. (2012). Glutathione in plants: an integrated overview. Plant, Cell & Environment, 35, 454–484.
- Pizzorno, J. (2014). Glutathione! Investigative Medicine, 13(1), 8–12.
- Qanungo, S., Starke, D. W., Pai, H. V, Mieyal, J. J., & Nieminen, A. (2007). Glutathione Supplementation Potentiates Hypoxic Apoptosis by S-Glutathionylation of p65-NFkB. The Journal of Biological Chemistry, 282(25), 18427–18436.
- Ramires, P. R., & Ji, L. L. (2001). Glutathione supplementation and training increases myocardial resistance to ischemia-reperfusion in vivo. Ann. J. Physiol. Heart Circ. Physiol., 281, 679–688.
- Sies, H. (2000). Glutathione and its Role in Cellular Functions. Free Radical Biology & Medicine R, 27(99), 916–921.
- Wu, G., Fang, Y., Yang, S., Lupton, J. R., & Turner, N. D. (2004). Glutathione Metabolism and Its Implications for Health. American Society for Nutritional Sciences, 489–492.
