Ciclohexano: estructura, usos, conformaciones
El ciclohexano es un cicloalcano relativamente estable con la fórmula molecular C6H12. Se trata de un líquido incoloro e inflamable que tiene un olor suave a solvente, pero que puede ser penetrante en presencia de impurezas.
Tiene una densidad de 0,779 g/cm3; hierve a 80,7°C; y se congela a 6,4°C. Se considera insoluble en el agua, pues su solubilidad solo puede ser de apenas 50 ppm (aprox.) a temperatura ambiente. Sin embargo, se mezcla fácilmente con alcohol, éter, cloroformo, benceno y acetona.
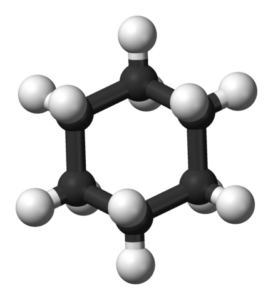
Los sistemas anillados del ciclohexano son más comunes entre las moléculas orgánicas de la naturaleza que las de otros cicloalcanos. Esto puede deberse tanto a su estabilidad como a la selectividad que ofrecen sus conformaciones bien establecidas.
De hecho, los carbohidratos, esteroides, productos vegetales, pesticidas y muchos otros compuestos importantes contienen anillos parecidos a los del ciclohexano, cuyas conformaciones resultan de gran importancia para su reactividad.
Índice del artículo
El ciclohexano es un hidrocarburo alicíclico de seis miembros. Existe principalmente en una conformación en la que todos los enlaces C-H en los átomos de carbono vecinos están escalonados, con ángulos diédricos iguales a 60°.
Debido a que tiene el ángulo y la tensión de torsión más bajos de todos los cicloalcanos, se considera que el ciclohexano presenta un cero con respecto a la tensión total del anillo. Esto también hace que el ciclohexano sea el más estable de los cicloalcanos y, por lo tanto, produzca la menor cantidad de calor cuando se quema en comparación con los otros cicloalcanos.
Hay dos tipos de posiciones para los sustituyentes en el anillo del ciclohexano: posiciones axiales y posiciones ecuatoriales. Los enlaces ecuatoriales C-H se encuentran en una banda alrededor del ecuador del anillo.
A su vez, cada átomo de carbono tiene un hidrógeno axial que es perpendicular al plano del anillo y paralelo a su eje. Los hidrógenos axiales se alternan hacia arriba y hacia abajo; cada átomo de carbono tiene una posición axial y una ecuatorial; y cada lado del anillo tiene tres posiciones axiales y tres ecuatoriales en una disposición alterna.
El ciclohexano se estudia mejor construyendo un modelo molecular físico o con un programa de modelado molecular. Cuando se utiliza alguno de estos modelos, es posible observar fácilmente las relaciones de torsión y la orientación de los átomos de hidrógeno ecuatoriales y axiales.
Sin embargo, también se puede analizar la disposición de los átomos de hidrógeno en una proyección de Newman al observar cualquier par de enlaces C-C paralelos.
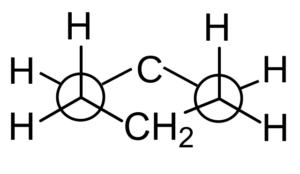
El ciclohexano puede presentarse en dos conformaciones que son interconvertibles: bote y silla. Sin embargo, esta última es la conformación más estable, pues no hay ángulo ni tensión torsional en la estructura del ciclohexano; más del 99% de las moléculas están en una conformación de silla en cualquier momento dado.
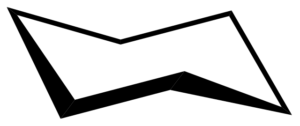
En una conformación de silla, todos los ángulos de enlace C-C son de 109,5°, lo que los libera de tensión angular. Debido a que los enlaces C-C están perfectamente escalonados, la conformación de la silla también está libre de tensión torsional. Además, los átomos de hidrógeno en las esquinas opuestas del anillo de ciclohexano están separados al máximo.
La conformación de la silla puede tomar otra forma denominada conformación del bote. Esto ocurre como resultado de rotaciones parciales sobre los enlaces simples C-C del anillo. Tal conformación tampoco presenta tensión angular, pero sí tiene tensión torsional.
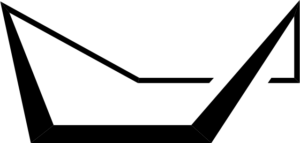
Cuando se ve un modelo de la conformación de bote, en los ejes de enlace C-C a lo largo de cada lado, se encuentra que los enlaces C−H en esos átomos de carbono están eclipsados, produciendo tensión torsional.
Además, dos de los átomos de hidrógeno están lo suficientemente cerca uno del otro como para generar fuerzas de repulsión de Van Der Waals.
Si la conformación de bote se flexiona, se obtiene la conformación del bote torcido que puede aliviar parte de la tensión torsional y también reducir las interacciones entre los átomos de hidrógeno.
Sin embargo, la estabilidad obtenida por la flexión es insuficiente para hacer que la conformación de bote torcido sea más estable que la conformación de la silla.
Casi todo el ciclohexano que se produce comercialmente (más del 98%) es ampliamente utilizado como materia prima en la producción industrial de los precursores del nylon: ácido adípico (60%), caprolactama y hexametilendiamina. El 75% de la caprolactama producida en todo el mundo se usa para la fabricación de nylon 6.

Sin embargo, el ciclohexano también se emplea en la fabricación de benceno, cloruro de ciclohexilo, nitrociclohexano, ciclohexanol y ciclohexanona; en la fabricación de combustible sólido; en formulaciones fungicidas; y en la recristalización industrial de esteroides.
Una fracción muy pequeña del ciclohexano producido se usa como solvente no polar para la industria química y diluyente en reacciones poliméricas. También se puede usar como removedor de pintura y barniz; en la extracción de aceites esenciales; y sustitutos de vidrio.
Debido a sus propiedades químicas y conformacionales únicas, el ciclohexano también se usa en laboratorios química analítica para determinaciones de peso molecular y como estándar.
El ciclohexano está presente en el petróleo crudo en concentraciones que varían entre 0.1 y 1.0%. Por lo tanto, solía producirse tradicionalmente por la destilación fraccionada de la nafta en la que se obtenía un concentrado de 85% de ciclohexano mediante superfraccionamiento.
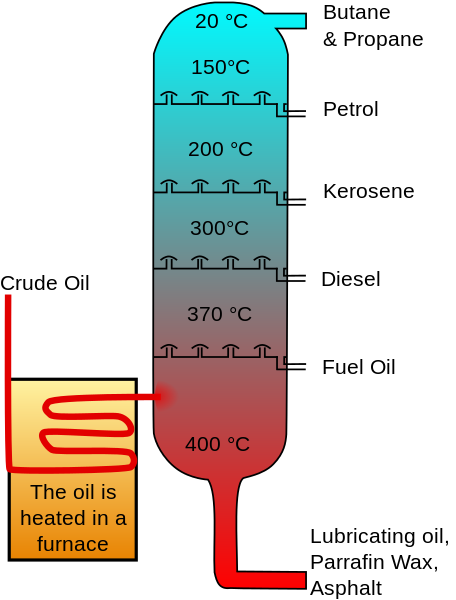
Este concentrado se vendía así, pues una purificación adicional requería llevar a cabo un proceso de isomerización de pentanos, craqueo por calor para eliminar hidrocarburos de cadena abierta y tratamiento con ácido sulfúrico para eliminar compuestos aromáticos.
Gran parte de la dificultad de obtener ciclohexano con una mayor pureza se debía a la gran cantidad de componentes del petróleo con puntos de ebullición similares.
En la actualidad, el ciclohexano se produce a escala industrial haciendo reaccionar benceno con hidrógeno (hidrogenación catalítica) debido a la simplicidad del proceso y su alta eficiencia.
Esta reacción se puede llevar a cabo utilizando métodos de fase líquida o de vapor en presencia de un catalizador altamente disperso o en un lecho fijo catalítico. Se han desarrollado varios procesos en los que se usa níquel, platino o paladio como catalizador.
La mayoría de las plantas de ciclohexano utilizan gas de reformador que produce benceno y grandes cantidades de subproductos de hidrógeno como materia prima para la producción de ciclohexano.
Debido a que los costos de hidrógeno y benceno son críticos para la fabricación de ciclohexano de manera rentable, las plantas suelen ubicarse cerca de grandes refinerías donde hay disponibles materias primas de bajo costo.
- Campbell, M. L. (2014). Cyclohexane. Ullmann’s Encyclopedia of Industrial Chemistry (7th ed.). New York: John Wiley & Sons.
- McMurry, J. (2011). Fundamentals of Organic Chemistry (7th ed.). Belmont: Brooks/Cole.
- National Center for Biotechnology Information. (2020) PubChem Database. Cyclohexane, CID=8078. Bethesda: National Library of Medicine. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Ouellette, R. J., & Rawn, J. D. (2014). Organic Chemistry – Structure, Mechanism, and Synthesis. San Diego: Elsevier.
- Petrucci, R. H., Herring, F. G., Bissonnette, C., & Madura, J. D. (2017). General Chemistry: Principles and Modern Applications (11th ed.). New York: Pearson.
- Solomons, T. W., Fryhle, C. B., & Snyder, S. A. (2016). Organic Chemistry (12th ed.). Hoboken: John Wiley & Sons.
- Wade, L. G. (2013). Organic Chemistry (8th ed.). New York. Pearson.
