Cloruro de zinc (ZnCl2): estructura, propiedades, obtención, usos
El cloruro de zinc es un compuesto inorgánico formado por el elemento zinc o cinc (Zn) y el cloro (Cl). Su fórmula química es ZnCl2. El cinc se encuentra en el estado de oxidación +2 y el cloro posee una valencia de -1.
Es un sólido cristalino incoloro o blanco. Es muy soluble en agua y la absorbe fácilmente del ambiente, lo cual se puede apreciar en la figura del sólido humedecido que se muestra a continuación.

El cinc de este compuesto es biológicamente muy importante para humanos, animales y plantas, pues interviene en funciones básicas como la síntesis de proteínas y grasas.
Por esta razón el ZnCl2 se utiliza como complemento nutricional de animales y humanos en casos de deficiencia de cinc, y como micronutriente para las plantas.
Posee propiedades bacteriostáticas y astringentes, y es muy utilizado con estos fines tanto en medicina humana como veterinaria. Elimina además plagas como hongos en exteriores y es intermediario para la obtención de pesticidas.
Entre sus múltiples usos sirve para tratar fibras de celulosa y lana en diversos procesos, así como para prepararlos para su coloración o impresión. Además retarda la combustión de la madera.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades
- 4 Rol biológico
- 5 Obtención
- 6 Usos
- 6.1 En tratamientos terapéuticos
- 6.2 Como suplemento nutricional
- 6.3 En aplicaciones veterinarias
- 6.4 En cementos especiales
- 6.5 Como catalizador
- 6.6 En actividades agrícolas
- 6.7 En aplicaciones odontológicas
- 6.8 En la industria textil y papelera
- 6.9 En la preparación de nanopartículas
- 6.10 En varias aplicaciones
- 7 Riesgos
- 8 Referencias
El ZnCl2 es un compuesto iónico formado por el catión Zn2+ y dos aniones cloruro Cl– que se unen mediante fuerzas electrostáticas.
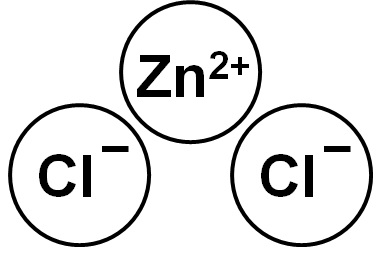
El ion cinc (II) tiene la siguiente estructura electrónica:
1s2, 2s2 2p6, 3s2 3p6 3d10, 4s0,
en la cual se observa que perdió ambos electrones de la capa 4s, por lo cual la configuración es estable.
El ion cloruro presenta la siguiente estructura:
1s2, 2s2, 2p6, 3s2 3p6,
la cual también es muy estable por tener los orbitales completos.
En la figura a continuación se puede observar la forma en que se disponen los iones en el cristal. Las esferas grises representan el zinc y las esferas verdes al cloro.

- Cloruro de cinc (II)
- Dicloruro de cinc
Sólido incoloro o blanco cristalino. Cristales hexagonales.
136,3 g/mol
290 ºC
732 ºC
2,907 g/cm3 a 25 °C
Muy soluble en agua: 432 g/100 g H2O a 25 °C, 614 g/100 g de H2O a 100 °C. Muy soluble en ácido clorhídrico (HCl), alcohol y glicerol. Totalmente miscible con acetona.
Sus soluciones acuosas son ácidas. Una solución de 6 moles de ZnCl2/L tiene un pH de 1,0.
Es un compuesto higroscópico y delicuescente, pues en contacto con la humedad del ambiente absorbe mucha agua. En agua se hidroliza y tiene la tendencia a formar una sal básica insoluble de oxicloruro de cinc.
Reacciona con el óxido de zinc (ZnO) en agua generando oxicloruros de zinc que constituyen un material extremadamente duro tipo cemento.
Es suavemente corrosivo hacia los metales.
No es inflamable.
Biológicamente el cinc es uno de los elementos más importantes. Se ha reconocido como esencial para todas las formas de vida.
En el cuerpo humano el ZnCl2 proporciona Zn, que es primordial para la síntesis de las proteínas, colesterol y grasas. Particularmente el cinc es importante para el buen funcionamiento del sistema inmune.
Se han identificado más de 25 proteínas que contienen cinc, y muchas de estas son enzimas, necesarias en la división y crecimiento celular, y para la liberación de vitamina A desde el hígado.
La deficiencia de cinc puede conducir a retardos en el crecimiento, función mental deprimida, anorexia, dermatitis, disminución de la inmunidad, diarrea y visión nocturna deficiente, entre otras condiciones.
Comercialmente este compuesto se prepara haciendo reaccionar ácido clorhídrico acuoso con chatarra, desechos de cinc o con el mineral que lo contenga. En esta reacción se produce además hidrógeno gaseoso (H2).
Tratando cinc con el gas cloruro de hidrógeno a 700 °C se obtiene cloruro de cinc de alta pureza.
Zn + HCl → ZnCl2 + H2↑
Es un antibacteriano suave o bacteriostático, por lo que se usa en duchas vaginales para eliminar infecciones por tricomonas o por haemophilus. Sirve también para tratar callos, como astringente y en quimiocirugía en cáncer de piel.
Se utiliza como astringente en algunos cosméticos tales como lociones refrescantes para la piel.
Por su importancia en diversas funciones del organismo humano el ZnCl2 se administra oralmente como parte de complementos nutricionales y también en personas que requieren alimentación parenteral.
Los suplementos de ZnCl2 se suministran para tratar la deficiencia de cinc en individuos que sufren de nutrición inadecuada, presentan mala absorción intestinal o alguna condición que aumenta la pérdida de este elemento del organismo.

Los individuos sanos lo adquieren a través de los alimentos.
Debe suministrarse por lo menos 1 hora antes de las comidas o 2 horas después de estas, pues algunos alimentos pueden impedir su absorción. En pacientes que presentan irritación en el estómago tras la ingestión del suplemento deben ingerirlo con las comidas, pero de esta forma el cinc estará menos biodisponible.
Sus soluciones se han utilizado en animales como agente cáustico para quemar o cauterizar fístulas, las cuales son conexiones entre órganos que no son normales ni saludables; en forma de pasta sirve para tratar úlceras y en quimioterapia de cáncer.
En infecciones oculares una solución muy diluida de este compuesto actúa como antiséptico y astringente.
También se emplea como trazas en alimentación animal o como suplemento alimenticio.
La reacción entre el ZnCl2 y el ZnO en agua produce algunos oxicloruros de cinc que conforman un material extremadamente duro o cemento. Los principales constituyentes son 4ZnO•ZnCl2•5H2O y ZnO•ZnCl2•2H2O.
Este tipo de cementos resiste el ataque de ácidos o de agua hirviente. Sin embargo, el pentahidrato es muy estable e insoluble pero poco trabajable, y el dihidrato es más soluble y puede causar drenaje de líquidos.
Por estas razones estos cementos tienen pocas aplicaciones.
Sirve para acelerar algunas reacciones de química orgánica. Actúa como agente condensante. Por ejemplo, en reacciones aldólicas, reacciones de aminación y reacciones de adición de ciclos. En algunas de estas actúa como iniciador de radicales.
Es un ácido Lewis y cataliza reacciones de Diels-Alder. También se usa como catalizador en reacciones de Friedel-Crafts, para fabricar tintes y colorantes, y en la manufactura de resinas de poliéster-poliéter.
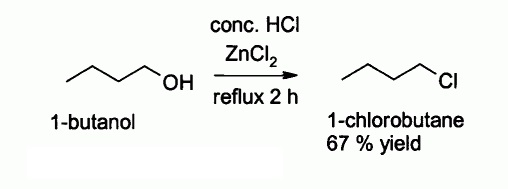
A continuación se muestra una reacción en la que interviene este compuesto:
Se ha empleado como herbicida en cultivos, como tratamiento foliar, para eliminar plagas como hongos y musgo, y como micronutriente. Es intermediario para preparar pesticidas.
Se usa en lavados bucales, sin embargo el tiempo de contacto recomendado es muy corto, por lo que solo actúa como astringente en la mucosa bucal. Sirve como desensibilizante, se utiliza en pastas dentífricas y forma parte de los cementos dentales.
Es ingrediente del solvente que se utiliza en la fabricación de rayón o seda artificial a partir de la celulosa. Es un agente de reticulación o unión para el acabado de resinas sobre textiles. Sirve también para tratarlos y favorecer su conservación.
Permite rizar telas, separar fibras de seda y lana, y actúa como mordiente en impresión y coloración de textiles.
Se usa en la manufactura de pergaminos de papel y para producir papel crepé.
Al hacer reaccionar cloruro de zinc con sulfuro de sodio (Na2S) mediante un método sonoquímico y en presencia de ciertos compuestos orgánicos se obtienen nanopartículas de sulfuro de cinc (ZnS). Los métodos sonoquímicos emplean ondas sonoras para provocar reacciones químicas.
Este tipo de nanomateriales podría tener aplicación como agentes fotocatalíticos para producir, por ejemplo, la división del agua en sus componentes (hidrógeno y oxígeno) mediante la acción de la luz.
- Desodorante, antiséptico y desinfectante de áreas. Control de musgo, moho y hongos en estructuras y áreas adyacentes exteriores como aceras, patios y cercas. Desinfectante de inodoros, urinarios, alfombras y madera comprimida.
- Utilizado en mezclas para embalsamar y en soluciones para la conservación de especímenes anatómicos.
- Retardador de llama para madera.
- Ingrediente primario en bombas de humo usadas para dispersar una multitud de personas; los bomberos las usan en ejercicios o prácticas de combate contra incendios y las fuerzas militares para propósitos de ocultamiento.

- Componente de flujos de soldadura. En la grabación sobre metales. Para colorear acero, componente de baños de galvanizado y enchapado de hierro con cobre.
- En cementos de magnesio y en cemento para metales.
- Para romper emulsiones en la refinación del petróleo. Agente en la manufactura de asfalto.
- Electrolito en baterías secas.

- Vulcanización de gomas.
- Agente deshidratante.
Puede causar quemaduras en los ojos, piel y membranas mucosas.
Cuando se calienta hasta su descomposición emite gases tóxicos de cloruro de hidrógeno (HCl) y óxido de cinc (ZnO).
Aunque faltan estudios concluyentes se estima que si este compuesto es administrado a mujeres embarazadas puede causar daños al feto. Pero los beneficios potenciales podrían tener más peso que los posibles riesgos.
- U.S. National Library of Medicine. (2019). Zinc chloride. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Liska, M. et al. (2019). Special Cements. Zinc Oxychloride Cement. In Lea’s Chemistry of Cement and Concrete (Fifth Edition). Recuperado de sciencedirect.
- Pohanish, R.P. (2017). Zinc Chloride. In Sittig’s Handbook of Toxic and Hazardous Chemicals and Carcinogens (Seventh Edition). Recuperado de sciencedirect.com.
- Gedanken, A. and Perelshtein, I. (2015). Power ultrasound for the production of nanomaterials. In Power Ultrasonics. Recuperado de sciencedirect.
- Archibald, S.J. (2003). Transition Metal Groups 9-12. Reactions and Catalysis. In Comprehensive Coordination Chemistry II. Recuperado de sciencedirect.com.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Lide, D.R. (editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
