Sulfato de cobre (CuSO4): estructura, propiedades, obtención, usos
El sulfato de cobre es un compuesto inorgánico formado por los elementos cobre (Cu), azufre (S) y oxígeno (O). Su fórmula química es CuSO4. El cobre se encuentra en estado de oxidación +2, el azufre +6, y el oxígeno tiene valencia -2.
Es un sólido blanco que cuando se expone a la humedad del ambiente se convierte en su pentahidrato de color azul CuSO4•5H2O. El sólido blanco se obtiene calentando el azul para eliminar el agua.

Se ha empleado como agente antibacteriano desde hace siglos para curar heridas en humanos y animales. Funciona también como fungicida, como astringente, antidiarreico y controlar enfermedades intestinales en animales. También se usa como agente antihongos en plantas.
Sin embargo, algunos de sus usos han sido descontinuados debido a que su exceso puede ser tóxico tanto para humanos, animales y plantas. El intervalo de concentraciones en el cual se puede utilizar es estrecho y depende de la especie.
Se emplea como catalizador en reacciones químicas y como desecante de solventes. Permite mejorar la resistencia y flexibilidad de algunos polímeros.
Cantidades excesivas de este compuesto pueden resultar dañinas en los suelos, pues es tóxico para microorganismos que son beneficiosos para las plantas.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades
- 4 Obtención
- 5 Usos
- 5.1 Como agente antibacterial
- 5.2 En aplicaciones veterinarias
- 5.3 Como suplemento en alimentación animal
- 5.4 En aplicaciones agrícolas
- 5.5 Importancia del cobre en las plantas
- 5.6 Efectos adversos en la agricultura
- 5.7 En catálisis de reacciones químicas
- 5.8 Como agente deshidratante
- 5.9 Para mejorar polímeros
- 5.10 En aplicaciones terapéuticas descontinuadas
- 6 Referencias
El sulfato de cobre está formado por un ion cobre (Cu2+) y un ion sulfato (SO42-).
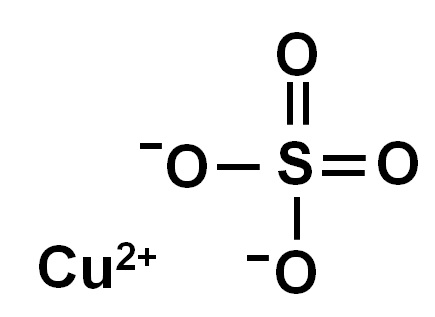
Debido a la pérdida de dos electrones el ion cobre (II) posee la siguiente conformación electrónica:
1s2 2s2 2p6 3s2 3p6 3d9
Se puede observar que tiene el orbital 3d incompleto (tiene 9 electrones en lugar de 10).
- Sulfato de cobre anhidro
- Sulfato de cobre (II)
- Sulfato cúprico
Sólido blanco o blanco verdoso en forma de cristales.
159,61 g/mol
A 560 ºC se descompone.
3,60 g/cm3
22 g/100 g de agua a 25 °C. Insoluble en etanol.
Cuando se somete a la humedad del aire por debajo de los 30 °C se convierte en el compuesto pentahidratado CuSO4•5H2O.
Sus soluciones acuosas son azules debido a la formación del ion hexaacuocobre (II)[Cu(H2O)6]2+ el cual produce dicha coloración. En este ion dos de las moléculas de agua están más lejos del átomo metálico que las otras cuatro.
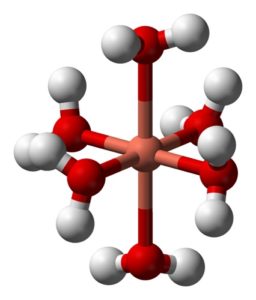
Esto se debe al llamado efecto Jahn-Teller, que predice que este tipo de sistemas experimenten la distorsión causada por el hecho de que el Cu2+ posee una estructura electrónica que finaliza en d9, esto es, un orbital incompleto (estaría completo si fuese d10).
Si se añade amoníaco (NH3) a estas soluciones se forman complejos en los que el NH3 va desplazando sucesivamente las moléculas de agua. Se forman por ejemplo desde el [Cu(NH3)(H2O)5]2+ hasta el [Cu(NH3)4(H2O)2]2+.
Cuando el CuSO4 se calienta hasta su descomposición emite gases tóxicos y se convierte en óxido cúprico CuO.
El sulfato de cobre anhidro se puede obtener por deshidratación total del compuesto pentahidratado, lo cual se logra calentándolo hasta que las moléculas de agua se evaporen.
CuSO4•5H2O + calor → CuSO4 + 5 H2O↑
El compuesto pentahidratado es azul por lo que al perder el agua de cristalización se obtiene el CuSO4 anhidro blanco.
Algunos de sus usos se solapan con el del compuesto pentahidratado. Otros son específicos de la sustancia anhidra.
Tiene potencial como agente antimicrobiano. Ha sido usado por miles de años, incluso en culturas de Sudamérica y América Central, para prevenir la infección de heridas mediante gasas impregnadas en una solución de este compuesto.
Se estima que en el mecanismo de su actividad antibacterial los iones Cu2+ forman quelatos con enzimas que son cruciales para las funciones celulares de las bacterias, desactivándolas. Además inducen la formación de radicales hidroxilo OH•, los cuales dañan las membranas de las bacterias y su ADN.
Recientemente se ha reportado que las trazas de CuSO4 pueden incrementar la actividad antimicrobiana de productos naturales ricos en polifenoles, tales como los extractos de la granada e infusiones de algunos tipos de plantas de té.
Se utiliza como un antiséptico y astringente para membranas mucosas y para tratar conjuntivitis y otitis externa. Sirve para realizar baños terapéuticos o profilácticos para evitar la pudrición de las patas del ganado vacuno, ovejas y otros mamíferos.

Sirve como agente cáustico para masas necróticas en las extremidades del ganado, úlceras de estomatitis y tejido granulado de estos. Tiene uso como fungicida en el tratamiento de la tiña y enfermedades causadas por hongos en la piel.
Se emplea además como emético (agente para provocar el vómito) en cerdos, perros y gatos; como astringente antidiarreico para terneros y para controlar la moniliasis intestinal en aves de corral y la tricomoniasis en pavos.
El sulfato de cobre se ha empleado como suplemento en cantidades muy pequeñas para la alimentación de ganado, cerdos y aves de corral. Sirve para tratar la deficiencia de cobre en rumiantes. En el caso de los cerdos y las aves se emplea como estimulante del crecimiento.
El cobre ha sido identificado como esencial para la biosíntesis de la hemoglobina en los mamíferos, estructura cardiovascular, síntesis del colágeno de los huesos, sistemas de enzimas y reproducción.
Como se menciona en la sección anterior también se puede suministrar como medicación para el control de enfermedades. Sin embargo, los niveles de suplementación y/o medicación deben ser vigilados con atención.

A partir de cierta cantidad, la cual depende de cada especie, puede ocurrir disminución del crecimiento, pérdida de apetito y peso, daño en ciertos órganos e incluso la muerte de los animales.
Por ejemplo, en gallinas la suplementación de 0,2% o más disminuye la ingestión de alimentos de estas con la consecuente pérdida de peso, disminución de la producción de huevos y del grosor de sus cáscaras.
En sistemas de producción orgánicos no está permitido emplear fungicidas sintéticos, solo se aceptan productos basados en cobre y azufre, tales como el sulfato de cobre.
Por ejemplo, ciertos hongos que atacan las plantas de manzana, como el Venturia inaequalis, son eliminados con este compuesto. Se piensa que posiblemente los iones Cu2+ son capaces de entrar en la espora del hongo, desnaturalizar las proteínas y bloquear varias enzimas.

El elemento cobre tiene importancia en procesos fisiológicos de las plantas tales como la fotosíntesis, respiración y defensa contra los antioxidantes. Tanto la deficiencia de este elemento como su exceso generan especies oxigenadas reactivas que son dañinas para las moléculas y estructuras de estas.
El intervalo de concentraciones de cobre para un crecimiento y desarrollo óptimos de las plantas es muy estrecho.
Cuando este producto es empleado en exceso en actividades agrícolas puede resultar fitotóxico, causar desarrollo prematuro de las frutas y cambiar su coloración.
Además, el cobre se acumula en el suelo y es tóxico para los microorganismos y lombrices de tierra. Esto entra en conflicto con el concepto de agricultura orgánica.

El CuSO4 anhidro sirve como catalizador para varias reacciones de compuestos orgánicos carbonílicos con dioles o sus epóxidos, formando dioxolanos o acetónidos. Gracias a este compuesto las reacciones se pueden realizar bajo condiciones suaves.
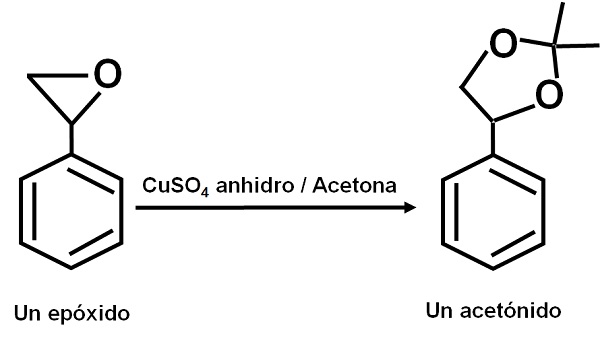
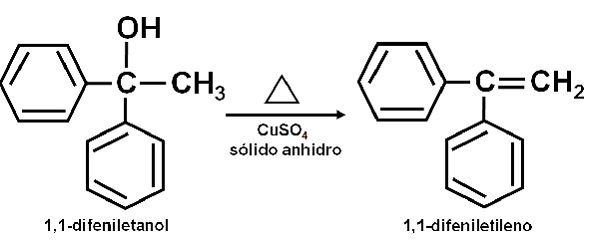
También se ha reportado que su acción catalítica permite deshidratar alcoholes secundarios, terciarios, bencílicos y alílicos a sus olefinas correspondientes. La reacción se realiza de forma muy sencilla.
El alcohol puro se calienta junto con el CuSO4 anhidro a una temperatura de 100-160 °C por un tiempo de 0,5-1,5 horas. Se produce así la deshidratación del alcohol y la olefina se destila pura de la mezcla de reacción.
Este compuesto se usa en los laboratorios de química como desecante. Sirve para deshidratar líquidos orgánicos como los solventes. Absorbe el agua formando el compuesto pentahidratado CuSO4•5H2O.

El CuSO4 anhidro se ha empleado para mejorar las propiedades de ciertos polímeros y a la vez permitir que sean reciclables.
Por ejemplo, se han mezclado partículas del compuesto en acetona con goma de acrilonitrilo-butadieno en un molino especial, tratando de que las partículas de CuSO4 sean muy pequeñas.
El sulfato de cobre mejora los puntos de unión del polímero formándose una mezcla con alta resistencia, dureza y sorprendente flexibilidad.
En el pasado se utilizaban las soluciones de sulfato de cobre para lavados gástricos cuando alguien sufría un envenenamiento por fósforo blanco. Sin embargo, la solución se removía con prontitud para evitar el envenenamiento por el cobre.
También se usaban las soluciones de este compuesto junto con otras sustancias para aplicaciones tópicas en quemaduras en la piel por fósforo.
En ocasiones servían en ciertas formas de anemia nutricional en niños y en la deficiencia de cobre en sujetos que recibían nutrición parenteral, es decir, personas que no se pueden alimentar por la boca.
Ciertas lociones para eczemas, impétigo e intertrigo contenían CuSO4. Las soluciones se usaban como astringente en infecciones oculares. A veces se aplicaban los cristales directamente sobre quemaduras o úlceras.
Todas estas aplicaciones ya no se realizan por la toxicidad que puede inducir el exceso de este compuesto.
- U.S. National Library of Medicine. (2019). Copper sulfate. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Lide, D.R. (editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Montag, J. et al. (2006). An in Vitro Study on the Postinfection Activities of Copper Hydroxide and Copper Sulfate against Conidia of Venturia inaequalis. J. Agric. Food Chem. 2006, 54, 893-899. Recuperado de link.springer.com.
- Holloway, A.C. et al. (2011). Enhancement of antimicrobial activities of whole and sub-fractionated white tea by addition of copper (II) sulphate and vitamin C against Staphylococcus aureus; a mechanistic approach. BMC Complement Altern Med 11, 115 (2011). Recuperado de bmccomplementmedtherapies.biomedcentral.com.
- Sanz, A. et al. (2018). Copper uptake mechanism of Arabidopsis thaliana high-affinity COPT transporters. Protoplasma 256, 161-170 (2019). Recuperado de link.springer.com.
- Griminger, P. (1977). Effect of copper sulfate on egg production and shell thickness. Poultry Science 56: 359-351, 1977. Recuperado de academic.oup.com.
- Hanzlik, R.P. and Leinwetter, M. (1978). Reactions of Epoxides and Carbonyl Compounds Catalyzed by Anhydrous Copper Sulfate. J. Org. Chem., Vol.43, No.3, 1978. Recuperado de pubs.acs.org.
- Okonkwo, A.C. et al. (1979). Copper Requirement of Baby Pigs Fed Purified Diets. The Journal of Nutrition, Volume 109, Issue 6, June 1979, Pages 939-948. Recuperado de academic.oup.com.
- Hoffman, R.V. et al. (1979). Anhydrous Copper(II) Sulfate: An Efficient Catalyst for the Liquid-Phase Dehydration of Alcohols. J. Org. Chem., 1980, 45, 917-919. Recuperado de pubs.acs.org.
- Shao, C. et al. (2018). Improved tensile strength of acrylonitrile-butadiene rubber/anhydrous copper sulfate composites prepared by coordination cross-linking. Polym. Bull. 76, 1435-1452 (2019). Recuperado de link.springer.com.
- Betts, J.W. et al. (2018). Novel Antibacterials: Alternatives to Traditional Antibiotics. Copper. In Advances in Microbial Physiology. Recuperado de sciencedirect.com
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Google Sites. Make Anhydrous Copper Sulfate. In Paradox Home Chemistry. Recuperado de sites.google.com.
