Acetato de plomo: estructura, propiedades, obtención, usos
El acetato de plomo o acetato de plomo (II) es un compuesto formado por un ion plomo (Pb2+) y dos iones acetato (CH3COO–). Su fórmula química es (CH3COO)2Pb o también Pb(CH3COO)2.
Se le conoce también como “azúcar de plomo” por tener un sabor dulce. Sin embargo, es una sustancia muy venenosa. Es un sólido cristalino muy soluble en agua. Puede reaccionar fácilmente con el sulfuro de hidrógeno (H2S) generando sulfuro de plomo (PbS) marrón, lo cual se utiliza en la detección de este gas tóxico en procesos industriales.

En la antigüedad se obtenía con relativa facilidad, por lo que tenía usos que actualmente están completamente prohibidos debido a la toxicidad de este compuesto.
El polvo de acetato de plomo no debe dispersarse en el ambiente, pues forma mezclas explosivas con el oxígeno. Además, es un compuesto cancerígeno para animales y humanos.
Se absorbe en los tejidos orgánicos más fácilmente que otros compuestos de plomo. Tiende a bioacumularse en los seres vivos, por lo que no debe desecharse al ambiente.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades
- 4 Obtención
- 5 Usos antiguos
- 6 Usos actuales
- 7 Riesgos
- 8 Referencias
El acetato de plomo (II) posee la estructura que se muestra en la figura a continuación:
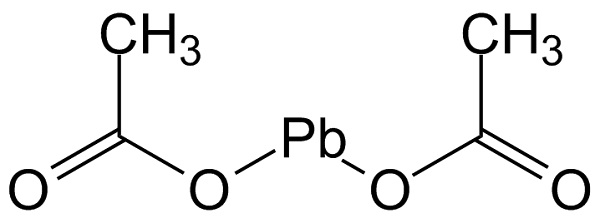
- Acetato de plomo (II)
- Diacetato de plomo
- Etanoato de plomo
- Acetato plumboso
- Azúcar de plomo
- Sal de Saturno
Sólido cristalino incoloro a blanco.
325 g/mol
280 ºC
No hierve. Se descompone al ser calentado.
3,25 g/cm3
Muy soluble en agua: 44,3 g/100 mL a 20°C. Insoluble en alcohol.
Una solución acuosa al 5% posee un pH de 5,5-6,5.
Cuando el Pb(OCOCH3)2 se disuelve en agua una parte se ioniza de la siguiente manera:
Pb(OCOCH3)2 → Pb2+ + 2 CH3COO–
Sin embargo, parte de las moléculas no se ioniza y queda en la forma:
CH3COO-Pb-OCOCH3.
Cuando el ion Pb2+ entra en solución se hidroliza parcialmente en el agua generando la especie Pb4(OH)44+.
Las soluciones acuosas de acetato de Pb (II) disuelven el óxido de plomo (PbO).
Reacciona con sulfuro de hidrógeno (H2S) para formar un sólido marrón de sulfuro de plomo (PbS).
Pb(OCOCH3)2 + H2S → PbS + 2 CH3COOH
Si se añade una solución acuosa de amoníaco (NH3) a una solución de acetato de plomo se forma un precipitado o sólido blanco de acetato básico.
Emite un olor similar al del vinagre. Posee un sabor dulce. Su forma comercial más común es el trihidrato Pb(CH3COO)2•3H2O.

Se puede preparar disolviendo óxido o carbonato de plomo (II) en ácido acético concentrado. También se pueden utilizar pequeñas placas delgadas de plomo metálico.
PbO + 2 CH3COOH → (CH3COO)2Pb + H2O
Se utilizaba en solución diluida para aplicarlo como cataplasmas y lavados en inflamaciones causadas por hiedra venenosa y como astringente en lociones. También para tratar diarreas.
Se empleaba como loción astringente y sedante en el tratamiento de inflamaciones superficiales y magulladuras.
Se fabricaba en la época romana antigua. Algunas mujeres lo aplicaban a su rostro para aparentar palidez, lo que no era solo una moda, sino una cuestión de estatus social.
Una tez blanca indicaba que la mujer no pertenecía a la clase trabajadora, sino a los niveles más altos de la sociedad romana. Y esto ocurría a pesar de que los médicos de la época, como Plinio El Viejo, conocían algunos de sus efectos nocivos.
Por su sabor dulce se usó en la antigüedad como sustituto del azúcar, en especial en el vino y para endulzar y conservar frutas.
Algunos de estos usos aún se aplican, pero la literatura consultada no es clara al respecto:
- En pigmentos de cromo, como componente en colorantes para adhesivos, en jabones orgánicos secantes para pinturas, barnices y tintas, como repelente de agua, en pinturas antiincrustaciones.
- En el proceso de obtención de oro mediante cianuros, para recubrir metales con plomo.
- Como mordiente en colorantes para algodón, componente de baños fijadores para papel de impresión con luz solar.
- Para tratar toldos y muebles para exteriores y así prevenir la remoción de agentes que protegen contra el moho y el deterioro por lluvia o el lavado.
En ciertos procesos industriales se utiliza para detectar el tóxico H2S en corrientes gaseosas mediante un papel de prueba en el cual sirve como indicador. El límite de detección es de 5 ppm (partes por millón).

En pruebas recientes se ha logrado incorporar a nanofibras junto con un polímero resultando un material de detección novedoso que permite revelar la presencia de 400 ppb (partes por billón) de H2S incluso a humedades del 90%.
El alto potencial de este nanomaterial como sensor colorimétrico lo hace aplicable a la detección de H2S en el aliento de personas que sufren de halitosis, cuyo rango se encuentra por debajo de 1 ppm.

Permite preparar otros compuestos de plomo como el carbonato y el cromato, sales de plomo de ácidos grasos de alto peso molecular y antioxidantes para gomas.
Según algunas fuentes consultadas este compuesto aún se emplea en tintes para el cabello cuyas indicaciones de aplicación advierten que no se debe utilizar en otras partes del cuerpo diferentes al cuero cabelludo.
También forma parte de productos analgésicos de uso externo y protectores de la piel.
Sin embargo, en ambos casos no se tienen suficientes evidencias para establecer el grado de seguridad de estos productos, por lo que en países como Canadá y en el estado de California de los EEUU ha sido prohibido su uso en todo tipo de cosméticos o para aplicación en la piel.
No es combustible, pero si se dispersa en el ambiente en forma de partículas finas puede generar mezclas explosivas con el aire.
Debe almacenarse lejos de compuestos oxidantes, ácidos fuertes y metales químicamente activos, y en áreas sin drenajes o acceso a alcantarillas que conducen a aguas servidas.
Puede irritar los ojos, el tracto respiratorio y el digestivo, causando dolor de cabeza, nausea, vómitos, cólicos, debilidad muscular, calambres, convulsiones, parálisis, mareos, pérdida de la conciencia, coma e incluso la muerte.
El acetato de plomo se absorbe alrededor de 1,5 veces más rápido que otros compuestos de plomo.

A muy bajas concentraciones sanguíneas en los niños puede causar hiperactividad o discapacidad neuroconductual, pues genera efectos sobre el sistema nervioso. También puede producir anemia y daño en los riñones.
En el caso de los animales se ha comprobado suficientemente que es tóxico para la reproducción, carcinógeno y teratogénico. Se estima que afecta de igual forma a los seres humanos.
Se le considera una sustancia peligrosa para el ambiente, pues es un contaminante tóxico. Es muy dañino para los organismos acuáticos. Debe prestarse especial atención a aves, mamíferos, contaminación de suelos y calidad del agua.
Puede ocurrir bioacumulación de este compuesto en plantas y animales. Las instituciones ecológicas internacionales advierten encarecidamente no permitir que entre en el ambiente porque es persistente.
Uno de los sucesos estudiados ha sido el del presidente de los Estados Unidos Andrew Jackson (1767-1845), el cual fue sometido a un tratamiento con “azúcar de plomo”, que en aquellos tiempos era un remedio tradicional con variados propósitos.
En 1999 se realizaron medidas a dos muestras de cabello obtenidas en vida del presidente y se encontró que los niveles de plomo eran muy altos en ambas muestras, lo que es compatible con los síntomas de plumbismo que sufría.

Tanto sus cartas como su biógrafo describen que presentaba síntomas como nauseas, cólicos abdominales y reumatismo paralítico, entre otros. Pero luego de un tiempo Jackson abandonó el tratamiento de acetato de plomo, por lo que su salud mejoró.
Por lo tanto, se estima que su muerte probablemente no se debió al envenenamiento por plomo.
- U.S. National Library of Medicine. (2019). Lead(II) acetate. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Lide, D.R. (editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Ghazi, A.M. and Millette, J.R. (1964). Lead. Lead Acetate. In Environmental Forensic. Recuperado de sciencedirect.com.
- Mushak, P. (2011). Lead and Public Health. In Trace Metals and other Contaminants in the Environment. Recuperado de sciencedirect.com.
- Cha, J.-H. et al. (2018). Sub-Parts-per-Million Hydrogen Sulfide Colorimetric Sensor: Lead Acetate Anchored Nanofibers toward Halitosis Diagnosis. Anal Chem 2018 Aug 7; 90(15): 8769-8775. Recuperado de ncbi.nlm.nih.gov.
- Wikimedia Foundation (2020). Lead(II) acetate. Recuperado de en.wikipedia.org.
- Stewart, S. (2015). “Gleaming and Deadly White”. A Fair Complexion. In History of Toxicology and Environmental Health. Recuperado de sciencedirect.com.
- Deppisch, L.M. et al. (1999). Andrew Jackson’s exposure to mercury and lead: poisoned president? JAMA 1999 Aug 11; 282(6): 569-71. Recuperado de ncbi.nlm.nih.gov.
