Carbono primario: características, tipos y ejemplos
El carbono primario es aquel que en cualquier compuesto, sin importar su entorno molecular, forma enlace con al menos otro átomo de carbono. Este enlace puede ser simple, doble (=), o triple (≡), siempre y cuando solo haya dos átomos de carbono enlazados y en posiciones adyacentes (lógicamente).
A los hidrógenos presentes en este carbono se les llama hidrógenos primarios. Sin embargo, las características químicas de los hidrógenos primarios, secundarios y terciarios, difieren poco y se encuentran predominantemente sujetas a los entornos moleculares del carbono. Es por esta razón que suele tratarse el carbono primario (1°) con más importancia que sus hidrógenos.
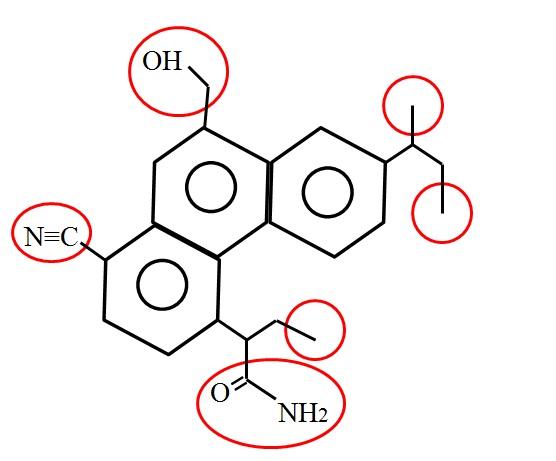
Y, ¿cómo luce un carbono primario? La respuesta depende, como se ha hecho mención, de su entorno molecular o químico. Por ejemplo, en la imagen superior se indican los carbonos primarios, encerrados dentro de círculos rojos, en la estructura de una molécula hipotética (aunque probablemente real).
Si se observan cuidadosamente, se encontrará que tres de ellos son idénticos; mientras que los otros tres son totalmente diferentes. Los primeros tres consisten de grupos metilos, -CH3 (a la derecha de la molécula), y los demás son los grupos metilol, -CH2OH, nitrilo, -CN, y una amida, RCONH2 (a la izquierda de la molécula y debajo de ella).
Índice del artículo
Arriba se mostraron seis carbonos primarios, sin más comentarios que sus ubicaciones y qué otros átomos o grupos los acompañan. Pueden estar en cualquier lugar de la estructura, y dondequiera que estén, señalan el “final del camino”; es decir, donde se termina un tramo del esqueleto. Es por eso que a veces se les conoce como carbonos terminales.
Así, resulta obvio que los grupos -CH3 son terminales y su carbono es 1°. Nótese que este carbono se enlaza a tres hidrógenos (los cuales se han omitido en la imagen) y a un único carbono, completando sus cuatro respectivos enlaces.
Por lo tanto, todos se caracterizan por tener un enlace C-C, enlace que también puede ser doble (C=CH2) o triple (C≡CH). Esto sigue siendo cierto aun si hay otros átomos o grupos enlazados a dichos carbonos; tal y como sucede con los otros tres carbonos 1° restantes de la imagen.
Se mencionó que los carbonos primarios son terminales. Al señalar el final de un tramo del esqueleto, no hay otros átomos interfiriendo con ellos espacialmente. Por ejemplo, los grupos -CH3 pueden interactuar con átomos de otras moléculas; pero sus interacciones con átomos vecinos de la misma molécula son bajas. Lo mismo aplica para el -CH2OH y -CN.
Esto se debe a que están prácticamente expuestos al “vacío”. Por lo tanto, generalmente presentan bajo impedimento estérico en relación a los otros tipos de carbono (2°, 3° y 4°).
No obstante, hay excepciones, producto de una estructura molecular con demasiados sustituyentes, alta flexibilidad o una tendencia a encerrarse sobre sí misma.
Una de las consecuencias del menor impedimento estérico alrededor del carbono 1°, es una mayor exposición a reaccionar con otras moléculas. Mientras menos átomos estorben el paso de la molécula atacante hacia él, más probable será su reacción.
Pero, esto es cierto solo desde el punto de visto estérico. Realmente el factor más importante es el electrónico; es decir, cuál es el entorno de dichos carbonos 1°.
El carbono adyacente al primario, le transfiere parte de su densidad electrónica; y lo mismo puede ocurrir en sentido contrario, favoreciéndose un determinado tipo de reacción química.
Así, los factores estérico y electrónico explican el por qué suele ser el más reactivo; aunque, no existe verdaderamente una regla de reactividad global para todos los carbonos primarios.
Los carbonos primarios carecen de una clasificación intrínseca. En lugar de ello, se clasifican en función de los grupos de átomos a que pertenecen o con que están enlazados; estos son, los grupos funcionales. Y como cada grupo funcional define un tipo de compuesto orgánico en específico, se tienen distintos carbonos primarios.
Por ejemplo, el grupo –CH2OH deriva del alcohol primario RCH2OH. Los alcoholes primarios por tanto constan de carbonos 1° enlazados al grupo hidroxilo, -OH.
El grupo nitrilo, -CN o -C≡N, por otro lado, solo puede enlazarse directamente a un átomo de carbono mediante el enlace simple C-CN. De esta manera, no cabría esperarse la existencia de nitrilos secundarios (R2CN) o mucho menos terciarios (R3CN).
Un caso similar sucede con el sustituyente derivado de la amida, -CONH2. Puede sufrir sustituciones de los hidrógenos del átomo de nitrógeno; pero su carbono solo podrá enlazarse a otro carbono, y por lo tanto siempre se considerará como primario, C-CONH2.
Y respecto al grupo -CH3, es un sustituyen alquílico el cual solo puede enlazarse a otro carbono, siendo por tanto primario. Si se considera por otra parte el grupo etilo, -CH2CH3, se notará inmediatamente que el CH2, grupo metileno, es un carbono 2° por estar enlazado a dos carbonos (C-CH2CH3).
Se ha hecho mención de algunos ejemplos de carbonos primarios. Adicional a ellos se tiene el siguiente par de grupos: -CHO y -COOH, llamados formilo y carboxilo, respectivamente. Los carbonos de estos dos grupos son primarios, ya que siempre formarán compuestos con fórmulas RCHO (aldehídos) y RCOOH (ácidos carboxílicos).
Este par está muy relacionado entre sí debido a las reacciones de oxidación que sufre el grupo formilo para transformarse en carboxilo:
RCHO => RCOOH
Reacción que sufren los aldehídos o el grupo -CHO si está como sustituyente en una molécula.
La clasificación de las aminas depende exclusivamente del grado de sustitución de los hidrógenos del grupo -NH2. Sin embargo, en las aminas lineales pueden observarse carbonos primarios, como en la propanamina:
CH3-CH2-CH2-NH2
Nótese que el CH3 siempre será un carbono 1°, pero esta vez el CH2 de la derecha también es 1° ya que está enlazado a un solo carbono y al grupo NH2.
Un ejemplo muy similar al anterior se da con los halogenuros de alquilo (y en muchos otros compuestos orgánicos). Supóngase el bromopropano:
CH3-CH2-CH2-Br
En él los carbonos primarios continúan siendo los mismos.
A modo de conclusión, los carbonos 1° trascienden el tipo de compuesto orgánico (e incluso organometálico), debido a que pueden estar presentes en cualquiera de ellos y se identifican sencillamente porque se enlazan a un único carbono.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Morrison, R. T. y Boyd, R. N. (1987). Química Orgánica. (5ta Edición). Editorial Addison-Wesley Interamericana.
- Ashenhurst J. (16 de junio de 2010). Primary, Secondary, Tertiary, Quaternary In Organic Chemistry. Master Organic Chemistry. Recuperado de: masterorganicchemistry.com
- Wikipedia. (2019). Primary carbon. Recuperado de: en.wikipedia.org
