Alquinos: qué son, estructura, propiedades, usos y ejemplos
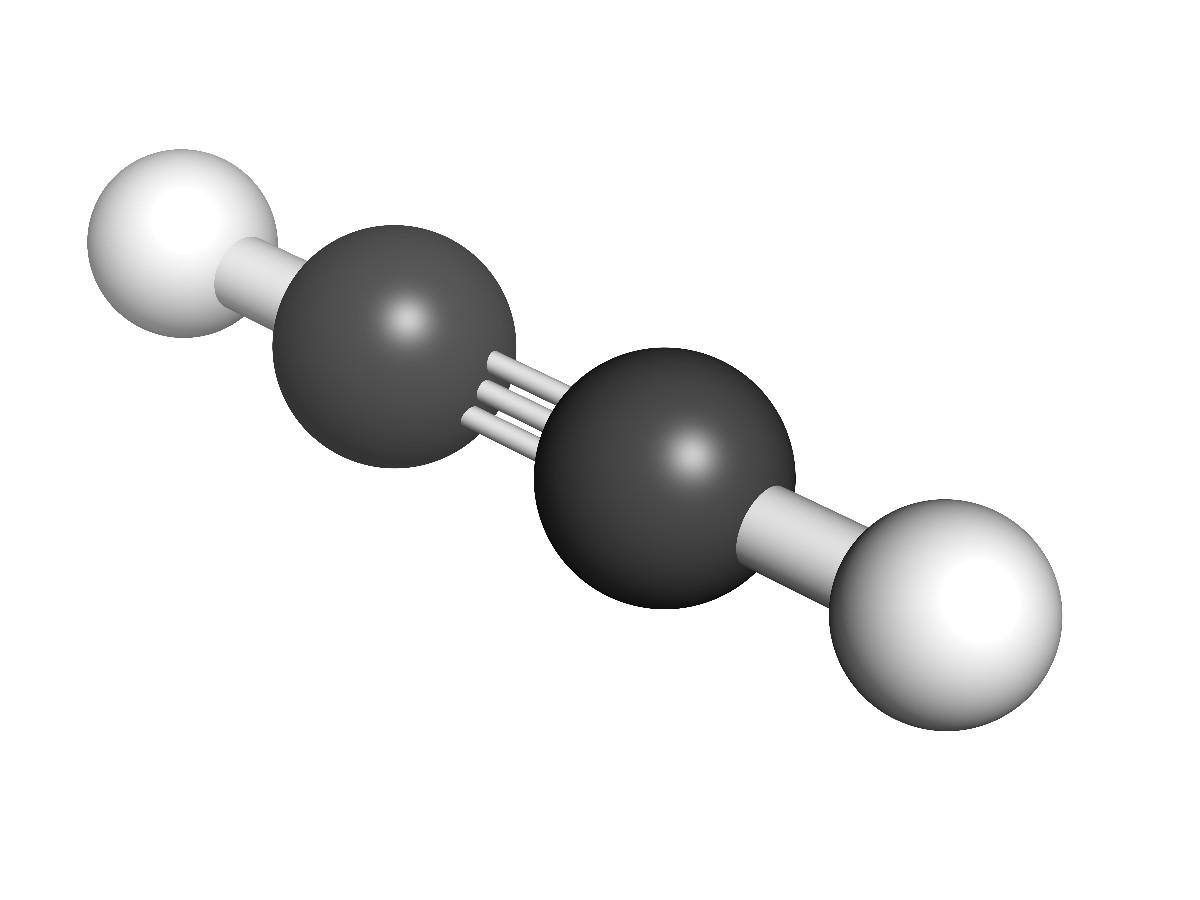
¿Qué son los alquinos?
Los alquinos son hidrocarburos o compuestos orgánicos que presentan en sus estructuras un triple enlace entre dos carbonos. Este triple enlace (≡) se considera un grupo funcional al representar un sitio activo de la molécula, y por tanto es responsable de la reactividad de los mismos.
Aunque los alquinos no se diferencien mucho de los alcanos o alquenos, estos exhiben mayor acidez y polaridad debido a la naturaleza de sus enlaces. El término preciso para describir esta leve diferencia es lo que se conoce como insaturación.
Los alcanos son hidrocarburos saturados, mientras que los alquinos son los más insaturados respecto a la estructura original. ¿Qué significa esto? Que un alcano H3C–CH3 (etano) puede deshidrogenarse a H2C=CH2 (eteno) y posteriormente a HC≡CH (etino, o mejor conocido como acetileno).
Nótese cómo a medida que se forman enlaces adicionales entre los carbonos disminuye el número de hidrógenos enlazados a ellos. El carbono, por sus características electrónicas, busca formar cuatro enlaces simples, por lo que a mayor insaturación mayor será la tendencia a reaccionar (a excepción de los compuestos aromáticos).
Por otro lado, el triple enlace es mucho más fuerte que el enlace doble (=) o el simple (–), pero a un costo energético alto. De aquí que la mayoría de los hidrocarburos (alcanos y alquenos) pueden formar triples enlaces a temperaturas elevadas.
Como consecuencia de las altas energías de estos, al romperse liberan mucho calor. Un ejemplo de este fenómeno se aprecia cuando se quema acetileno con oxígeno y se aprovecha el intenso calor de la llama para soldar o fundir metales.
El acetileno es el alquino más simple y pequeño de todos. De su fórmula química pueden expresarse otros hidrocarburos sustituyendo los H por grupos alquílicos (RC≡CR’). Lo mismo sucede en el mundo de las síntesis orgánicas mediante un gran número de reacciones.
Este alquino se produce de la reacción del óxido de calcio de la piedra caliza y coque, materia prima que aporta los carbonos necesarios dentro de un horno eléctrico:
CaO + 3C => CaC2 + CO
El CaC2 es el carburo de calcio, compuesto inorgánico que finalmente reacciona con agua para formar el acetileno:
CaC2 + 2H2O => Ca(OH)2 + HC≡CH
Propiedades físicas y químicas de los alquinos
Polaridad
El triple enlace distingue a los alquinos de los alcanos y alquenos. Los tres tipos de hidrocarburos son apolares, insolubles en agua y ácidos muy débiles. No obstante, la electronegatividad de los carbonos del doble y triple enlace es mayor que la de los carbonos simples.
Según esto, los carbonos adyacentes al triple enlace le ceden por efecto inductivo densidad de carga negativa. Por esta razón, donde están los enlaces C≡C o C=C habrá mayor densidad electrónica que en el resto del esqueleto carbonado. Como consecuencia, existe un momento dipolar pequeño por el que las moléculas interaccionan por fuerzas dipolo-dipolo.
Estas interacciones son muy débiles si se comparan sus momentos dipolares con los de la molécula del agua o cualquier alcohol. Esto se refleja en sus propiedades físicas: los alquinos generalmente presentan puntos de fusión y ebullición más altos comparados con los de sus hidrocarburos menos insaturados.
Igualmente debido a su escasa polaridad son menos insolubles en agua, pero sí solubles en solventes orgánicos apolares, como el benceno.
Acidez
Asimismo, esta electronegatividad ocasiona que el hidrógeno HC≡CR sea más ácido que cualquiera presente en otros hidrocarburos. Por lo tanto, los alquinos son especies más ácidas que los alquenos y mucho más que los alcanos. Sin embargo, su acidez sigue siendo despreciable si se la compara con la de los ácidos carboxílicos.
Dado que los alquinos son ácidos muy débiles, solo reaccionan con bases muy fuertes, como el amiduro de sodio:
HC≡CR + NaNH2 => HC≡CNa + NH3
De esta reacción se obtiene una solución de acetiluro de sodio, materia prima para la síntesis de otros alquinos.
Reactividad de los alquinos
La reactividad de los alquinos se explica por la adición de moléculas pequeñas a su triple enlace, disminuyendo su insaturación. Estas bien pueden ser moléculas de hidrógeno, halogenuros de hidrógeno, agua o halógenos.
Hidrogenación
La pequeña molécula de H2 es muy esquiva y veloz, por lo que para aumentar las probabilidades de que se adicionen al triple enlace de los alquinos debe recurrirse a los catalizadores.
Estos suelen ser metales (Pd, Pt, Rh o Ni) finamente divididos para aumentar el área superficial; y de este modo, el contacto entre el hidrógeno y el alquino:
RC≡CR’ + 2H2 => RCH2CH2R’
El resultado es que el hidrógeno se “ancla” a los carbonos rompiendo un enlace, y así sucesivamente hasta producir el alcano correspondiente, RCH2CH2R’. Esto no solo satura el hidrocarburo inicial, sino que además modifica su estructura molecular.
Adición de halogenuros de hidrógeno
Aquí se adiciona la molécula inorgánica HX, donde X puede ser cualquiera de los halógenos (F, Cl, Br o I):
RC≡CR’ + HX => RCH=CXR’
Hidratación
La hidratación de los alquinos es cuando estos adicionan una molécula de agua para formar un aldehído o una cetona:
RC≡CR’ + H2O => RCH2COR’
Si R’ es un H, se trata de un aldehído; si es un alquilo, entonces se trata de una cetona. En la reacción se forma como intermediario un compuesto conocido como enol (RCH=C(OH)R’).
Este sufre una conversión de la forma enólica (C–OH) a la cetónica (C=O) en un equilibrio llamado tautomerización.
Adición de halógenos
Y respecto a las adiciones, también pueden anclarse a los carbonos del triple enlace las moléculas diatómicas de los halógenos (X2= F2, Cl2, Br2 o I2):
RC≡CR’ + 2X2 => RCX2–CX2R’
Alquilación del acetileno
A partir de la solución de acetiluro de sodio pueden prepararse otros alquinos mediante el uso de un haluro de alquilo:
HC≡CNa + RX => HC≡CR + NaX
Por ejemplo, si se tratara del yoduro de metilo, entonces el alquino resultante sería:
HC≡CNa + CH3I => HC≡CCH3 + NaX
HC≡CCH3 es el propino, también conocido como metilacetileno.
Estructura química de los alquinos
¿Cuál es la estructura de los alquinos? En la imagen superior se muestra una molécula de acetileno. De ella puede observarse claramente la geometría lineal del enlace C≡C.
Por consiguiente, donde haya un triple enlace, la estructura de la molécula deberá ser lineal. Esta es otra de las notables diferencias entre ellos y el resto de los hidrocarburos.
Los alcanos suelen representarse como zigzags, debido a que tienen hibridación sp3 y sus enlaces están separados 109º. Son en realidad una cadena de tetraedros unidos covalentemente. Mientras que los alquenos son planos por la hibridación sp2 de sus carbonos, formando más específicamente un plano trigonal con enlaces separados por 120º.
En los alquinos la hibridación orbital es sp, es decir, tienen 50% de carácter s y 50% de carácter p. Son dos orbitales híbridos sp los que se enlazan a los átomos de H en el acetileno o a los grupos alquílicos en los alquinos.
La distancia que separan ambos H o R es de 180º, además de que solo de este modo los orbitales p puros de los carbonos pueden formar el triple enlace. Por esta razón el enlace –C≡C– es lineal. Viendo la estructura de cualquier molécula el –C≡C– resalta en aquellas regiones donde el esqueleto es muy lineal.
Distancia de los enlaces y alquinos terminales
Los carbonos en el triple enlace se encuentran a menor distancia que en el doble o el enlace simple. En otras palabras, C≡C es más corto que C=C y que C–C. A consecuencia de esto, el enlace es más fuerte porque contribuyen los dos enlaces π a estabilizar el enlace simple σ.
Si el triple enlace se encuentra al extremo de una cadena, entonces se trata de un alquino terminal. Por lo tanto la fórmula de dicho compuesto debe ser HC≡CR, donde el H remarca el final o inicio de la cadena.
Si por el contrario es un triple enlace interno, la fórmula es RC≡CR’, donde R y R’ son el lado derecho e izquierdo de la cadena.
Nomenclatura de los alquinos
¿Cómo se nombran los alquinos de acuerdo con las reglas dictaminadas por la IUPAC? Del mismo modo como se han nombrado los alcanos y los alquenos. Para ello se cambia el sufijo –ano o –eno por el sufijo –ino.
Por ejemplo: el HC≡CCH3 se le nombra propino, ya que tiene tres carbonos, como el propano (CH3CH2CH3). El HC≡CCH2CH3 es el 1-butino, el cual es un alquino terminal. Pero en el caso del CH3C≡CCH3 se trata del 2-butino, y en este el triple enlace no es terminal sino interno.
El CH3C≡CCH2CH2(CH3)2 es el 5-metil-2-hexino. Se comienza a contar los carbonos desde el lado más cercano al triple enlace.
Otro tipo de alquinos son los cicloalquinos. Para ellos basta con sustituir el sufijo –ano por –ino del cicloalcano correspondiente. Así el ciclopropano que tiene un triple enlace se nombra como ciclopropino (el cual no existe).
Cuando hay dos triples enlaces se adiciona al nombre el prefijo di-. Se tiene como ejemplos al HC≡C–C≡H, diacetileno o propadino; y al HC≡C–C–C≡H, butadiino.
Usos de los alquinos
Acetileno o etino
El más pequeño de los alquinos engrosa el número posible de usos para estos hidrocarburos. A partir de él mediante alquilaciones se puede sintetizar otros compuestos orgánicos. Asimismo, se somete a reacciones oxidativas para obtenerse etanol, ácido acético, ácido acrílico, entre otros.
Otros de sus usos consiste en proporcionar la fuente de calor para excitar los electrones de los átomos; más específicament,e de cationes metálicos en determinaciones por absorción-emisión atómica, técnica espectroscópica ampliamente utilizada.
Alquinos naturales
Los únicos métodos existentes para preparar alquinos no son solo sintéticos o con aplicación de calor en ausencia de oxígeno, sino también biológicos.
En estos se utilizan enzimas llamadas acetilenasas, las cuales pueden deshidrogenar un doble enlace. Gracias a esto se consiguen muchas fuentes naturales de alquinos.
A raíz de esto, de estas fuentes pueden extraerse venenos, antídotos, medicinas o cualquier otro compuesto que aporte algún beneficio; en especial cuando este concierne a la salud. Las alternativas son muchas al momento de modificar sus estructuras originales y disponer de ellas como soporte para nuevos alquinos.
Ejemplos de alquinos
Hasta el momento se han mencionado numerosos ejemplos de alquinos. Sin embargo, algunos provienen de fuentes muy específicas o tienen estructuras moleculares particulares: son poliacetilenos.
Esto quiere decir que puede haber más de un triple enlace que forma parte de una estructura muy grande, y no solo de una simple cadena carbonada.
Ácido tarírico
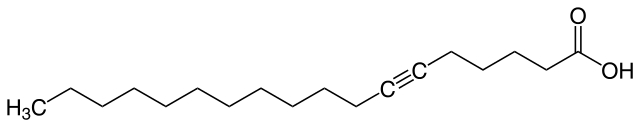
El ácido tarírico proviene de una planta ubicada en Guatemala llamada Picramnia tariri. Se extrae específicamente del aceite de sus semillas.
En su estructura molecular puede observarse un solo enlace triple que separa una cola apolar de una cabeza polar; por lo tanto podría considerarse como una molécula anfipática.
Histrionicotoxina
La histrionicotoxina es un veneno segregado por la piel de ranas habitantes de Colombia, Brasil y otros países latinoamericanos. Tiene dos triples enlaces conjugados con un enlace doble. Ambos son terminales y están separados por un anillo de seis carbonos y una amina cíclica.
Cicutoxina
A partir de la estructura molecular de la cicutoxina, ¿dónde están los triples enlaces? Si los dobles enlaces son planos, como se ven a la derecha, y los enlaces simples son tetraédricos, como en los extremos, los triples son lineales y están en la pendiente (/).
Este compuesto consiste en una neurotoxina encontrada principalmente en la planta de la cicuta acuática.
Capillina
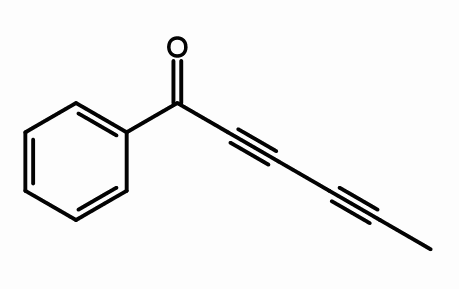
Es un alquino presente en el aceite esencial de las plantas de Artemisa que se utiliza como agente antifúngico. Pueden observarse dos triples enlaces consecutivos, más correctamente conjugados.
¿Qué significa? Que los triples enlaces resuenan a lo largo de toda la cadena carbonada e involucra que el enlace doble C=O se abra a C–O–.
Pargilina
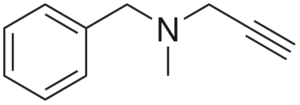
Es un alquino con actividad antihipertensiva. Analizando su estructura por partes se tiene: un grupo bencilo a la izquierda, una amina terciaria en el medio, y un propinilo a la derecha; es decir, un grupo propino terminal.
Referencias
- Francis A. Carey. Química Orgánica. Ácidos carboxílicos. (sexta edición., pág 368-397). Mc Graw Hill.
- Brennan, John. (10 de marzo de 2018). Examples of Alkynes. Sciencing. Tomado de: sciencing.com
- BYJU’S. (2018). Triple Bond in Alkynes. Tomado de: byjus.com
- Enciclopedia de Ejemplos (2017). Alquinos. Recuperado de: ejemplos.co
- Kevin A. Boudreaux. Alkynes. Tomado de: angelo.edu
- Robert C. Neuman, Jr. Alkenes and Alkynes. [PDF]. Tomado de: chem.ucr.edu
