Ecuación química: partes y ejemplos
La ecuación química es una representación esquemática de algunas de las características de una reacción química. También puede decirse que la ecuación química describe los cambios que experimentan las diferentes sustancias que intervienen en una reacción.
En la ecuación química se colocan las fórmulas y símbolos de las diferentes sustancias participantes, señalando claramente el número de átomos de cada elemento presente en los compuestos, el cual aparece como un subíndice y no puede cambiarse al balancear la ecuación.
La ecuación química debe aparecer balanceada, es decir, el número de átomos tanto de reactivos como de productos debe ser igual. De esta manera se obedece la ley de la conservación de la materia. Es deseable que los números usados en balancear las ecuaciones sean números enteros.
Estas ecuaciones no revelan los pasos consecutivos, ni por qué mecanismos los reactivos se transforman en productos.
Es por eso que si bien son muy útiles para entender hacia dónde va una reacción química, no permite comprender sus aspectos moleculares ni cómo se ve afectada por determinadas variables; tales como pH, viscosidad, tiempo de reacción, velocidad de agitación, entre otras.
Índice del artículo
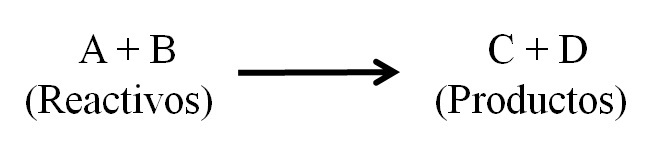
Básicamente hay tres partes principales en una ecuación química: los reactivos, los productos y la flecha que indica el sentido de la reacción química.
En la ecuación química aparecen todas las sustancias que funcionan como reactivos y todas las que son productos. Estos grupos de sustancias aparecen separadas por una flecha que indica el sentido de la reacción. Los reactivos se ubican a la izquierda de la flecha y los productos a la derecha.
La flecha significa qué se produce y está orientada de izquierda a derecha (→), aunque en las reacciones reversibles hay dos flechas equivalentes y paralelas; una dirigida hacia la derecha, y otra a la izquierda. Sobre la flecha suele colocarse el símbolo (Δ) indicando que en la reacción se usó calor.
Además, suele colocarse en la flecha la identificación del catalizador, si es posible con su fórmula o símbolo. Las diferentes sustancias que aparecen como reactivos están separadas por el signo (+), indicando que las sustancias reaccionan o se combinan entre sí.
En el caso de las sustancias que aparecen como productos el signo (+) no tiene la connotación anterior; a menos que la reacción sea reversible. Es conveniente que el signo (+) se coloque equidistante de las sustancias que separa.
Es un requisito imprescindible que las ecuaciones químicas estén debidamente balanceadas. Para ello se coloca un número llamado coeficiente estequiométrico. Siempre que sea necesario, dicho coeficiente debe ir delante de las sustancias que aparecen como reactivos o productos.
Esto es así para lograr que el número de todos los átomos de los elementos que aparece como reactivos sea exactamente igual al número de ellos que aparece en el producto. El método de balanceo de ecuaciones química más sencillo es el de tanteo.
En algunas ecuaciones químicas se señala con un subíndice el estado físico de las sustancias. Para ello se usa en castellano las siguientes abreviaturas: (s) para el estado sólido; (l) para el estado líquido; (g), estado gaseoso; y (ac), solución acuosa.
Ejemplo: reacción del carbonato de calcio con ácido clorhídrico.
CaCO3(s) + 2 HCl(ac) → CaCl2(s) + H2O(l) + CO2(g)
En algunos casos, se señala en la ecuación química si hay producción de un gas en la reacción química o si hay la precipitación de alguna de las sustancias producidas.
La presencia de un gas se señala con una flecha vertical con su extremo dirigido hacia arriba (↑), colocada al lado derecho de la sustancia gaseosa.
Ejemplo: reacción del zinc con el ácido clorhídrico.
Zn + 2 HCl → ZnCl2 + H2↑
Si en la reacción química una de las sustancias forma un precipitado, este se simboliza colocando una flecha vertical con su extremo dirigido hacia abajo (↓), colocada al lado derecho de la sustancia precipitada.
Ejemplo: reacción del ácido clorhídrico con nitrato de plata.
HCl + AgNO3 → HNO3 + AgCl↓

La fotosíntesis es un proceso mediante el cual las plantas captan y transforman la energía lumínica, proveniente de la luz solar, para generar la energía necesaria para su subsistencia. La fotosíntesis es realizada por unos organelos propios de las células vegetales denominados cloroplastos.
En la membrana de los cloroplastos se encuentran los tilacoides, sitios donde se encuentran las clorofilas a y b, las cuales son los principales pigmentos que captan la energía lumínica.
Si bien la fotosíntesis es un proceso complejo, se puede esquematizar en la ecuación química siguiente:
6 CO2 + 6 H2O → C6H12O6 + 6 O2↑ ΔGº = 2.870 kJ/mol
C6H12O6 es la fórmula de la glucosa, carbohidrato metabolizado para la producción de ATP; compuesto que es el principal reservorio de energía en la mayoría de los seres vivos. Además, a partir de la glucosa se genera NADPH, coenzima necesaria para numerosas reacciones.
Las células utilizan el oxígeno para el metabolismo de numerosas sustancias presentes en los alimentos ingeridos. Mientras, el ATP es empleado como fuente energética de las actividades realizadas por los seres vivos, produciéndose en estos procesos dióxido de carbono y agua.
Si se utiliza la glucosa como modelo de sustancia metabolizada, se puede esquematizar la respiración mediante la ecuación química siguiente:
C6H12O6 + 6 O2 → 6 CO2 + 6 H2O
Reacción de descomposición
Un compuesto o compuestos se disocia(n) formando con sus átomos otros compuestos diferentes:
2 KClO3(s) → 2 KCl(s) + 3 O2(g)
Reacción de desplazamiento
Un metal reacciona con un compuesto reemplazando un metal presente en este:
Mg(s) + CuSO4(ac) → Cu(s) + MgSO4(ac)
Reacción de eliminación
En este tipo de reacción disminuye el número de átomos o grupos unidos a un átomo de carbono:
CH3-CH2Br + NaOH → H2C=CH2 + H2O + NaBr
Reacción de hidratación
Es una reacción en la que un compuesto adiciona una molécula de agua. Esta reacción es importante en la preparación de alcoholes:
H2C=CH2 + H2O → H2C-CH2OH
Reacción de neutralización
Una base o álcali reacciona con un ácido produciéndose una sal y agua:
HCl(ac) + NaOH(ac) → NaCl(ac) + H2O(l)
Reacción de síntesis
En este tipo de reacción se combinan dos o más sustancias para originar un nuevo compuesto:
2 Li(s) + Cl2(g) → 2 LiCl(s)
Reacción de doble desplazamiento (metátesis)
En este tipo de reacción hay intercambio de iones positivos y negativos para formar compuestos nuevos:
AgNO3(ac) + NaCl(ac) → AgCl(s) + NaNO3(ac)
- Flores, J. (2002). Química. Edición 1era. Editorial Santillana
- Mathews, C. K., Van Holde, K. E., y Ahern, K. G. (2002). Bioquímica. 3era Edición. Editorial Pearson Addison Wesley
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Wikipedia. (2019). Chemical equation. Recuperado de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (20 de septiembre de 2019). What Is a Chemical Equation? Recuperado de: thoughtco.com
