Antimonio: historia, estructura, propiedades, usos y riesgos
El antimonio es un metaloide lustroso, plateado, y con cierta tonalidad azulosa. Su sólido se caracteriza además por ser muy quebradizo y de textura escamosa. Pertenece al grupo 15 de la tabla periódica, encabezado por el nitrógeno. Después del bismuto (y del moscovium), es el elemento más pesado del grupo.
Se representa mediante el símbolo químico Sb. En la naturaleza se encuentra principalmente en menas de minerales de estibita y ullmannita, cuyas fórmulas químicas son Sb2S3 y NiSbS, respectivamente. Su alta tendencia a formar sulfuros en lugar de óxidos se debe a que es químicamente blando.

Por otro lado, el antimonio también es blando físicamente, presentando una dureza de 3 en la escala de Mohs. Es estable a temperatura ambiente y no reacciona con el oxígeno del aire. Pero cuando se calienta en presencia de oxígeno, forma el trióxido de antimonio, Sb2O3.
Asimismo, es resistente a la acción de los ácidos débiles; pero en caliente es atacado por los ácidos nítrico y clorhídrico.
El antimonio tiene numerosas aplicaciones, entre ellas es empleado en aleaciones con el plomo y el estaño, en la fabricación de baterías para vehículos, materiales de baja fricción, etc.
Este metaloide tiene la rara propiedad de aumentar de volumen cuando se solidifica, permitiendo que sus aleaciones ocupen totalmente el espacio que se usa para moldear el instrumento que se desea fabricar.
Índice del artículo
- 1 Historia de su descubrimiento
- 2 Estructura del antimonio
- 3 Propiedades
- 3.1 Peso atómico
- 3.2 Número atómico
- 3.3 Configuración electrónica
- 3.4 Estados de oxidación
- 3.5 Descripción física
- 3.6 Punto de fusión
- 3.7 Punto de ebullición
- 3.8 Densidad
- 3.9 Calor de fusión
- 3.10 Calor de vaporización
- 3.11 Capacidad calórica molar
- 3.12 Electronegatividad
- 3.13 Radio atómico
- 3.14 Dureza
- 3.15 Estabilidad
- 3.16 Isótopos
- 3.17 Conductividad eléctrica y térmica
- 3.18 Reactividad química
- 4 Usos
- 5 Riesgos
- 6 Referencias
Hay evidencias que desde el año 3100 a.c, el sulfuro de antimonio era utilizado como cosmético en Egipto. En Mesopotamia, actual Irak, se hallaron restos de un jarrón y otro artefacto que, presuntamente, datan entre los años 3000 y 2200 a.c, en los cuales se usó en su elaboración antimonio.
El erúdito romano Plinio el Viejo (23-79 d.c) describió el uso del antimonio, al cual llamó estibio, en la elaboración de siete medicinas en su Tratado de Historia Natural. Al alquimista Abu Mussa Jahir Ibn Hayyan (721-815) se le atribuye la introducción del término antimonio para nombrar al elemento.
Usó la etimología siguiente: ‘anti’ como sinónimo de negación, y ‘mono’ por solamente. Entonces quiso recalcar que el antimonio no se encontraba solo en la naturaleza. Ya se sabe que forma parte de minerales sulfuros, al que igual que otros tantos elementos.
El naturista griego Pedanius Diascorides se cree que obtuvo antimonio puro, mediante el calentamiento de sulfuro de antimonio en una corriente de aire. El metalúrgico italiano Vannocio Biringucio, en el libro De la Pirotecnia (1540), hace una descripción de un método para aislar el antimonio.
El químico alemán Andreas Libavius (1615), mediante el uso de una mezcla fundida de hierro, sulfuro de antimonio, sal y tartrato de potasio, logró la producción de un antimonio cristalino.
El primer reporte detallado acerca del antimonio fue realizado en el año 1707 por el químico francés Nicolas Lemery (1645-1715), en su libro Tratado sobre el Antimonio.
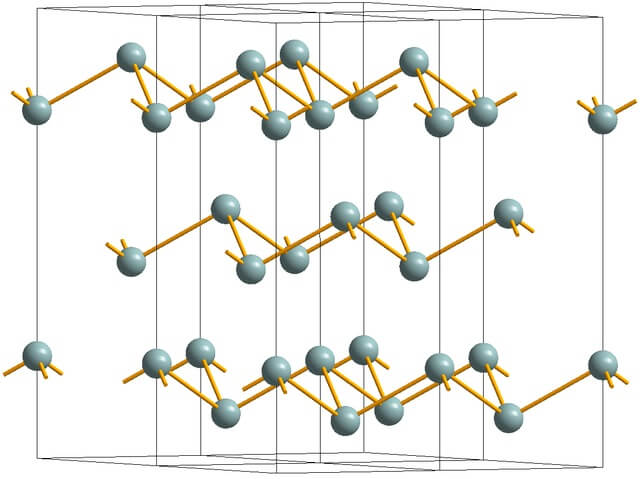
En la imagen superior se muestra la estructura de capas arrugadas adoptada por los átomos de arsénico. No obstante, el antimonio grisáceo, más conocido como antimonio metálico, también adopta esta estructura. Se dice que es “arrugada” porque hay átomos de Sb que suben y bajan del plano compuesto por la capa.
Estas capas, si bien son responsables de que los fotones que interaccionen con ella reluzcan brillos plateados, haciendo pasar al antimonio como un metal, la verdad es que las fuerzas que las unen son débiles; de aquí a que los aparentes fragmentos metálicos de Sb puedan molerse con facilidad y sean quebradizos o escamosos.
Además, los átomos de Sb en las capas arrugadas no están lo suficiente cerca para agrupar sus orbitales atómicos y crear así una banda que permita la conducción eléctrica.
Viendo una esfera grisácea individualmente, se podrá ver que posee tres enlaces Sb-Sb. Desde un plano superior, se podría apreciar al Sb en el centro de un triángulo, con tres Sb situados en sus vértices. Sin embargo, el triángulo no es plano y tiene dos niveles o pisos.
La reproducción lateral de tales triángulos y sus enlaces establece capas arrugadas, las cuales se alinean para formar cristales romboédricos.
La estructura recién descrita corresponde al antimonio grisáceo, el más estable de sus cuatro alótropos. Los otros tres alótropos (el negro, amarillo, y el explosivo) son metaestables; es decir, pueden existir bajo condiciones muy rigurosas.
No hay demasiada información concerniente a sus estructuras. Se sabe, no obstante, que el antimonio negro es amorfo, de manera que su estructura es desordenada e intrincada.
El antimonio amarillo es estable por debajo de los -90ºC, se comporta como un elemento no metálico, y puede conjeturarse que consista de pequeños aglomerados tipo Sb4 (parecidos a los del fósforo); cuando se calienta se transforma en el alótropo negro.
Y respecto al antimonio explosivo, consiste de un depósito gelatinoso formado sobre el cátodo durante la electrólisis de una solución acuosa de un haluro de antimonio.
Al menor roce o impacto fuertes, el sólido blando libera tanto calor que explota y se estabiliza al reagruparse sus átomos en la estructura cristalina romboédrica del antimonio grisáceo.
121,76 g/mol.
51.
[Kr]4d105s25p3.
-3, -2, -1, +1, +2, +3, +4, +5.
Sólido plateado lustroso, quebradizo, de superficie escamosa, con una tonalidad azulosa. También puede presentarse como un polvo negro.
630,63 ºC.
1.635 ºC.
-6,697 g/cm3 a temperatura ambiente.
-6,53 g/cm3 en estado líquido, temperatura igual o mayor al punto de fusión.
19,79 kJ/mol.
193,43 kJ/mol.
25,23 J/mol.K
2,05 (escala de Pauling).
140 pm.
Es un elemento blando, con una dureza de 3 en la escala de Mohs y puede ser rayado por el vidrio.
Es estable a temperatura ambiente, no experimentando oxidación. Igualmente es resistente al ataque de los ácidos.
Tiene dos isótopos estables: 121Sb y 123Sb. Además, existen 35 isótopos radiactivos. El isótopo radiactivo 125Sb es el de mayor vida media: 2,75 años. En general, los isótopos radiactivos emiten radiación β+ y β–.
El antimonio es un mal conductor del calor y la electricidad.
No puede desplazar al hidrógeno de los ácidos diluidos. Forma complejos iónicos con ácidos orgánicos e inorgánicos. El antimonio metálico no reacciona con el aire, pero es rápidamente convertido a óxido en el aire húmedo.
Los halógenos y los sulfuros oxidan fácilmente al antimonio, si el proceso ocurre a temperaturas elevadas.
El antimonio se usa en aleación con el plomo para la elaboración de placas para las baterías de automóviles, mejorando la resistencia de las placas, al igual que las características de las cargas.
La aleación con plomo y estaño ha sido usada para mejorar las características de las soldaduras, así como la de las balas trazadoras y los detonantes de cartuchos. También es usado en las aleaciones para el recubrimiento de cables eléctricos.
El antimonio es utilizado en las aleaciones antifricción, en la elaboración del peltre y aleaciones de endurecimiento con bajo contenido de estaño en la fabricación de los órganos y otros instrumentos musicales.
Presenta la característica, compartida con el agua, de aumentar de volumen cuando se condensa; por lo que el antimonio presente en las aleaciones con el plomo y el estaño, llena todos los espacios de los moldes, mejorando la definición de las estructuras elaboradas con dichas aleaciones.
El trióxido de antimonio se usa para la elaboración de compuestos ignífugos, siempre en combinación con retardantes del fuego halogenados, bromuros y cloruros.
Los retardantes del fuego pueden reaccionar con átomos de oxígeno y radicales OH, lo cual inhibe el fuego. Estos ignífugos se usan en ropas para niños, juguetes, aeronaves y en las butacas de los automóviles.
También se agregan en las resinas de poliéster, y en materiales compuestos de fibras de vidrio para artículos usados como cubierta de motores de aviones ligeros.
Los compuestos de antimonio que se usan como retardantes del fuego, incluyen: oxicloruro de antimonio, SbOCl; pentóxido de antimonio, SbO5; tricloruro de antimonio, SbCl3; y trióxido de antimonio, SbO3.
Se usa en la fabricación de semiconductores, diodos, detectores de infrarrojo medio, y en la elaboración de transitores. El antimonio de alta pureza, utilizado en la tecnología de los semiconductores, es obtenido por la reducción de compuestos de antimonio con hidrógeno.
Los compuestos de antimonio se han usado en medicina desde tiempos ancestrales como eméticos y antiprotozoarios. El tartrato potásico de potasio (emético tártaro) fue usado como antiesquistosómico durante mucho tiempo; usándose, además, como expectorante, diaforético y emético.
También se han usado sales de antimonio en el acondicionamiento de la piel de animales rumiantes; tales como la aniomalina, y el tiomalato de litio y antimonio.
El antimoniato de meglumina es un fármaco usado en el tratamiento de la leishmaniasis en focos externos de animales domésticos. Aunque, los beneficios terapéuticos fueron escasos.
Los compuestos de antimonio se utilizan en la elaboración de pinturas y opacificante en esmaltes. También se usan en pigmentos de colores bermellón, amarillo y anaranjado, los cuales son productos de la oxidación lenta de los sulfuros de antimonio.
Algunas de sus sales orgánicas (tartratos), son utilizadas en la industria textil para ayudar en el enlace de ciertos colorantes.
El sulfuro de antimonio fue utilizado en el antiguo Egipto como cosmético en el oscurecimiento de los ojos.
Algunas sales de antimonio son utilizadas como agentes de recubrimiento para eliminar las burbujas microscópicas que se forman en las pantallas de televisión. Los iones de antimonio interactúan con el oxígeno, eliminando su tendencia a formar burbujas.
El sulfuro de antimonio (III), se usa en las cabezas de algunos fósforos de seguridad. También se emplea el sulfuro de antimonio en la estabilización del coeficiente de fricción de los materiales empleados en las pastillas de freno para automóviles.
El isótopo 124Sb, conjuntamente con el berilio, se usa como fuente de neutrones, con un promedio energético de 24 keV. Además, el antimonio es utilizado como catalizador en la producción de plásticos.
Es un elemento quebradizo, por lo que puede producirse durante su manipulación un polvo contaminante del ambiente. En los trabajadores expuestos al polvo de antimonio, se ha podido observar dermatitis, renitis, inflamación de las vías respiratorias altas y conjuntivitis.
Se ha descrito neumoconiosis, en ocasiones combinada con cambios pulmonares obstructivos, tras exposiciones prolongadas.
El trióxido de antimonio puede provocar daños en el funcionamiento cardíaco que pueden ser mortales.
En personas expuestas a este elemento se ha observado la presencia de infecciones cutáneas pustulares, de carácter transitorio.
La ingesta continua de dosis bajas de este metal puede causar diarrea vómitos y úlceras estomacales. Asimismo, la concentración máxima tolerable en el aire es de 0,5 mg/m3.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Manny. (11 de marzo de 2009). Yellow Antimony and Explosive Antimony. Recuperado de: antimonyproperties.blogspot.com
- Prof. Ernst Cohen y J. C. Van Den Bosch. (1914). The Allotropy of Antimony. Proceedings Royal Acad. Amsterdam. Vol. XVII.
- Wikipedia. (2019). Antimony. Recuperado de: en.wikipedia.org
- Advameg, Inc. (2019). Antimony. Recuperado de: chemistryexplained.com
- Sable Mc’Oneal. (15 de septiembre de 2018). Chemistry: properties and application of Sb-Antimony. Recuperado de: medium.com
