Enlace covalente polar: características y ejemplos
Un enlace covalente polar es aquel formado entre dos elementos químicos cuya diferencia de electronegatividad es sustancial, pero sin aproximarse a un carácter puramente iónico. Es pues, una interacción fuerte intermedia entre los enlaces covalentes apolares y los enlaces iónicos.
Se dice que es covalente porque en teoría hay una compartición equitativa de un par electrónico entre los dos átomos enlazados; es decir, los dos electrones se comparten por igual. El átomo E· dona un electrón, mientras ·X aporta el segundo electrón para formar el enlace covalente E:X o E-X.
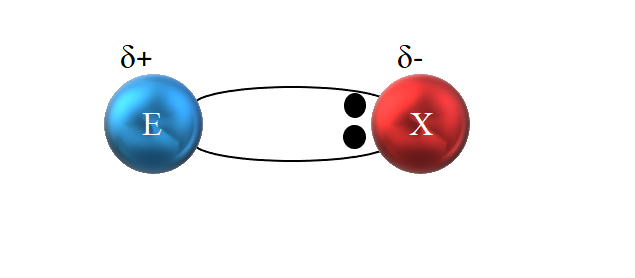
No obstante, tal como se ve en la imagen superior, los dos electrones no están situados en el centro de E y X, indicando que “circulan” con la misma frecuencia entre ambos átomos; sino que están más cerca de X que de E. Esto significa que X ha atraído el par de electrones hacia sí debido a su mayor electronegatividad.
Al estar los electrones del enlace más cerca de X que de E, entorno a X se crea una región de alta densidad electrónica, δ-; mientras que en E aparece una región pobre en electrones, δ+. Por lo tanto, se tiene una polarización de las cargas eléctricas: un enlace covalente polar.
Índice del artículo
Los enlaces covalentes son muy abundantes en la naturaleza. Prácticamente están presentes en todas las moléculas heterogéneas y en los compuestos químicos; ya que, a fin de cuentas se forma cuando dos átomos diferentes E y X se enlazan. Sin embargo, hay enlaces covalentes más polares que otros, y para averiguarlo se debe recurrir a las electronegatividades.
Cuánto más electronegativo sea X, y menos electronegativo sea E (electropositivo), entonces el enlace covalente resultante será más polar. El modo convencional para estimar dicha polaridad es mediante la fórmula:
χX – χE
Donde χ es la electronegatividad de cada átomo de acuerdo a la escala de Pauling.
Si esta resta o sustracción tiene valores comprendidos entre 0,5 y 2, entonces será un enlace polar. Por lo tanto, es posible comparar el grado de polaridad entre varios enlaces E-X. En caso de que el valor obtenido sea más alto que 2, se habla de un enlace iónico, E+X– y no Eδ+-Xδ-.
No obstante, la polaridad del enlace E-X no es absoluta, sino que depende de los entornos moleculares; es decir, en una molécula -E-X-, donde E y X forman enlaces covalentes con otros átomos, estos últimos influyen directamente en dicho grado de polaridad.
Si bien E y X pueden tratarse de cualquier elemento, no todos originan enlaces covalentes polares. Por ejemplo, si E es un metal altamente electropositivo, como los alcalinos (Li, Na, K, Rb y Cs), y X un halógeno (F, Cl, Br y I), tenderán a formar compuestos iónicos (Na+Cl–) y no moléculas (Na-Cl).
Es por eso que los enlaces covalentes polares suelen encontrarse entre dos elementos no metálicos; y en menor grado, entre elementos no metálicos y algunos metales de transición. Viendo el bloque p de la tabla periódica, se tiene muchas opciones para formar este tipo de enlaces químicos.
En las moléculas grandes no tiene mucha importancia pensar en qué tan polar sea un enlace; estas son altamente covalentes, y llama más la atención la distribución de sus cargas eléctricas (dónde están las regiones ricas o pobres de electrones) que definir el grado de covalencia de sus enlaces internos.
No obstante, con las moléculas diatómicas o pequeñas, dicha polaridad Eδ+-Xδ- es bastante relativa.
Esto no es problema con las moléculas formadas entre elementos no metálicos; pero cuando participan metales de transición o metaloides, ya no se habla solamente de un enlace covalente polar, sino de un enlace covalente con cierto carácter iónico; y en el caso de los metales de transición, de un enlace covalente de coordinación dada la naturaleza del mismo.
El enlace covalente entre el carbono y oxígeno es polar, debido a que el primero es menos electronegativo (χC = 2,55) que el segundo (χO = 3,44). Por lo tanto, cuando veamos los enlaces C-O, C=O o C-O–, sabremos que se tratan de enlaces polares.
Los halogenuros de hidrógeno, HX, son ejemplos ideales para comprender el enlace polar en sus moléculas diatómicas. Teniendo la electronegatividad del hidrógeno (χH = 2,2), podemos estimar qué tan polares son estos halogenuros entre sí:
-HF (H-F), χF (3,98) – χH (2,2) = 1,78
-HCl (H-Cl), χCl (3,16) – χH (2,2) = 0,96
-HBr (H-Br), χBr (2,96) – χH (2,2) = 0,76
-HI (H-I), χI (2,66) – χH (2,2) = 0,46
Nótese que de acuerdo a estos cálculos, el enlace H-F es el más polar de todos. Ahora, cuál es su carácter iónico expresado como porcentaje, es otro tema. Este resultado no es de extrañar debido a que el flúor es el elemento más electronegativo de todos.
Al descender la electronegatividad desde el cloro hasta el yodo, de igual modo se vuelven menos polares los enlaces H-Cl, H-Br y H-I. El enlace H-I debería ser apolar, pero en realidad es polar y además muy “quebradizo”; se rompe con facilidad.
El enlace polar O-H quizás sea el más importante de todos: gracias a él existe la vida, pues colabora con el momento dipolar del agua. Si estimamos la diferencia entre las electronegatividades del oxígeno e hidrógenos tendremos:
χO (3,44) – χH (2,2) = 1,24
No obstante, la molécula de agua, H2O, tiene dos de estos enlaces, H-O-H. Esto, y la geometría angular de la molécula y su asimetría, la vuelven un compuesto altamente polar.
El enlace N-H está presente en los grupos aminos de las proteínas. Repitiendo el mismo cálculo tenemos:
χN (3,04) – χH (2,2) = 0,84
Esto refleja que el enlace N-H es menos polar que O-H (1,24) y F-H (1,78).
El enlace Fe-O es importante porque se encuentran sus óxidos en los minerales de hierro. Veamos si es más polar que H-O:
χO (3,44) – χFe (1,83) = 1,61
De aquí se supone, acertadamente, que el enlace Fe-O es más polar que el enlace H-O (1,24); o lo que es igual a decir: Fe-O tiene mayor carácter iónico que H-O.
Estos cálculos sirven para figurar los grados de polaridad entre varios enlaces; pero no bastan para dictaminar si un compuesto es iónico, covalente, o su carácter iónico.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Laura Nappi. (2019). Polar and Nonpolar Covalent Bonds: Definitions and Examples. Study. Recuperado de: study.com
- Helmenstine, Anne Marie, Ph.D. (18 de septiembre de 2019). Polar Bond Definition and Examples (Polar Covalent Bond). Recuperado de: thoughtco.com
- Elsevier B.V.(2019). Polar Covalent Bond. ScienceDirect. Recuperado de: sciencedirect.com
- Wikipedia. (2019). Chemical polarity. Recuperado de: en.wikipedia.org
- Anonymous. (05 de junio de 2019). Properties of Polar Covalent Bonds. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
