Equilibrio químico: explicación, factores, tipos, ejemplos
El equilibrio químico es un estado que alcanzan las reacciones químicas reversibles en el que no se producen ninguna variación de las concentraciones, ni de los reactivos, como tampoco de los productos involucrados. Se caracteriza por ser dinámico y no estático; esto es, las moléculas u átomos siguen reaccionando, pero manteniendo las mismas concentraciones durante el tiempo.
Un equilibrio similar también se presenta en cambios de fase, aunque no haya rompimientos de enlaces. Por ejemplo, un líquido puede estar en equilibrio con sus vapores, al igual que como un sólido. Asimismo, un sólido establece un equilibrio con las aguas que lo rodean cuando ha precipitado o cristalizado.

Una vez establecido el equilibrio químico, no es posible obtener más cambios o respuestas a menos que este se interrumpa o se afecte por acciones externas. Es así pues, que en la síntesis de un producto se modifican varios parámetros como la presión, el volumen o la temperatura, para que en el equilibrio se genere la máxima cantidad de producto.
De lo contrario, en el equilibrio las cantidades de productos serán insatisfactorias; es decir, se tendrá un rendimiento pobre de reacción. Es por eso que el equilibrio químico es vital para la industria química, y en general para cualquier síntesis sin importar su escala.
En el equilibrio químico puede haber más cantidad de productos, o bien más cantidad de reactivos. Todo depende de hacia dónde esté desplazado el equilibrio. Teniendo en cuenta varios factores, se puede desplazar un equilibrio hacia cualquiera de las dos direcciones de la doble flecha en la reacción reversible.
Índice del artículo
- 1 Explicación del equilibrio químico
- 2 Factores que afectan el equilibrio químico
- 3 Tipos de equilibrio químico
- 4 Ejemplos de equilibrio químico
- 5 Ejercicios resueltos
- 6 Referencias
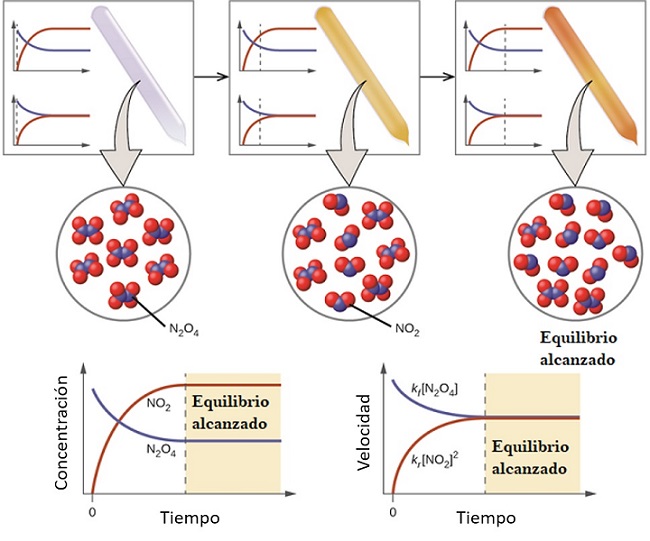
Para comprender qué es el equilibrio químico considérese la siguiente reacción reversible:
N2O4(g) ⇌ 2 NO2(g)
El gas N2O4 es incoloro, mientras que el gas NO2 presenta una coloración parda o café. Si en un vial o recipiente pequeño se inyecta una cantidad determinada de N2O4, este será incoloro hasta que no se establezca el equilibrio.
A la izquierda de la imagen superior, puede verse que casi todas las moléculas son de N2O4 y que la concentración de NO2 es cero.
Arriba se muestran además dos gráficas que representan cómo es la tendencia en el equilibrio, con la línea punteada señalando la posición en el momento que se inyecta solamente el N2O4. Una gráfica corresponde a Concentración vs. Tiempo (abajo mano izquierda) y la otra corresponde a la gráfica a Velocidad vs. Tiempo (abajo mano derecha).
La concentración de N2O4, [N2O4] (línea azul) irá disminuyendo paulatinamente, ya que parte de él se disociará para producir moléculas de NO2. Así, siendo la concentración de NO2, [NO2] (línea roja) igual a cero al principio, pronto aumentará a medida que el N2O4 se disocie.
Sin embargo, se trata de una reacción reversible: parte de las moléculas de NO2 se unirán para volver a formar N2O4. Se tendrá, pues, dos reacciones, la directa y la inversa, cada una con sus propias velocidades.

Al principio, la velocidad de consumo de N2O4 es mayor que la velocidad de consumo de NO2. Evidentemente, al haber solo N2O4, las pocas moléculas formadas de NO2 apenas podrán encontrarse para reaccionar. En este punto, el vial comenzará a teñirse de anaranjado, porque se tiene una mezcla de N2O4 y NO2.
Poco a poco, a medida que haya más moléculas de NO2 en el vial y que las moléculas de N2O4 se vayan disociando, las velocidades de las dos reacciones se irán igualando, aun cuando las concentraciones difieran entre sí cada vez más. Es decir, [NO2] tiende a ser mayor que [N2O4], razón por la que la línea roja se sitúa por encima de la línea azulada.
Nótese que la velocidad viene a ser dC/dt, es decir, el cambio de la concentración respecto al tiempo. Es por eso que las dos gráficas C vs. t y V vs. t no son idénticas.
Una vez el par N2O4-NO2 establezca el equilibrio, las velocidades de ambas reacciones se igualarán y se obtendrán las siguientes expresiones matemáticas:
Vdirecta = k1[N2O4]
Vinversa = k-1[NO2]2
Vdirecta = Vinversa
k1[N2O4] = k-1[NO2]2
k1/k-1 = [NO2]2/ [N2O4]
Keq = [NO2]2/ [N2O4]
En este punto, el vial se teñirá todavía más de pardo, ya que el equilibrio se encuentra más desplazado hacia la formación de [NO2]. Es decir, que Keq, la constante de equilibrio, debe ser mayor a 1 teniendo en cuenta la relación superior, [NO2]2/ [N2O4].
En el equilibrio las concentraciones [N2O4] y [NO2] se mantienen constantes, con ambas reacciones sucediendo a la misma velocidad: apenas se disocia cierta cantidad de N2O4, la misma cantidad volverá a producirse inmediatamente a causa de la reacción de cierta cantidad de NO2.
Por esta razón, se dice que el equilibrio químico es dinámico: las moléculas N2O4 y NO2 siguen participando en las reacciones aun cuando no haya cambio en sus concentraciones.
Y al ser las velocidades de reacción iguales para ambos sentidos, la línea roja y la azulada en la gráfica V vs. t se tocan en una línea horizontal.
La constante de equilibrio para la reacción anterior será siempre la misma, a determinada temperatura, sin importar cuánto N2O4 se inyecte al principio en el vial. Esto será así incluso si se inyecta directamente una mezcla de N2O4 y NO2, dejándose luego en reposo hasta que alcance el equilibrio.
Cuando el equilibrio se alcance y se midan las concentraciones [N2O4] y [NO2], la relación [NO2]2/ [N2O4] dará igual a Keq para esta reacción. Mientras más grande sea (Keq >> 1), más productos habrá en el equilibrio. Y mientras más pequeña sea ( Keq < 1), más reactivos habrá en el equilibrio.
Las concentraciones [N2O4] y [NO2] no serán las mismas siempre. Por ejemplo, si se inyectan volúmenes pequeños en el vial, o si por el contrario se inyectan torrentes de estos gases en un reactor, las cantidades variarán considerablemente. Sin embargo, Keq seguirá siendo el mismo siempre y cuando la temperatura sea la misma en ambos procesos.
Keq es susceptible a los cambios de temperatura: a mayor temperatura, mayor será su valor. Es decir, a mayor temperatura, en el equilibrio se tenderá a la formación de más productos. Esto es así a menos que la reacción sea exotérmica, como se explicará en el siguiente apartado.
Los factores que afectan el equilibrio químico en una reacción reversible son: concentración, presión y temperatura.
En una reacción reversible, según el Principio de Le Chatelier, al aumentar la concentración de un reactivo se producirá un desplazamiento del equilibrio químico hacia la derecha, con el fin de aumentar la concentración de los productos de la reacción.
Por el contrario, si se agrega un producto a la reacción, el equilibrio químico se desplazará hacia la izquierda, con el fin de aumentar la concentración de los reactivos. Si se toma como ejemplo la siguiente reacción:
C(s) + O2(g) ⇌ 2 CO(g)
Al aumentar la concentración de los reactivos (C y O2), el equilibrio se desplazará hacia la derecha, es decir, hacia la formación del producto monóxido de carbono (CO). Pero un aumento de la concentración de CO producirá un desplazamiento del equilibrio hacia la izquierda, para aumentar la concentración de C y O2.
En una reacción desarrollada en fase gaseosa, una variación en el volumen o en la presión ejercida sobre los gases que intervienen en ella, producirá una alteración en el equilibrio, dependiente del número de moles de los reactivos y los productos.
Si los componentes de una reacción (reactivos y productos) tienen diferencias en el número de moles que intervienen en una reacción, por ejemplo, la dimerización del dióxido de nitrógeno (NO2):
2 NO2(g) ⇌ N2O4(g)
Un aumento de la presión ejercida sobre la reacción en fase gaseosa, consecuencia de una disminución o no del volumen de la reacción, provocará un desplazamiento del equilibrio químico hacia el lado que tiene menos moles gaseosos. En este ejemplo: el producto N2O4.
Por el contrario, una disminución de la presión producirá un desplazamiento del equilibrio hacia el lado de la reacción que posea el mayor número de moles de gas. En el ejemplo dado, se desplazará hacia los reactivos (NO2), con el fin de contrarrestar la disminución de la presión.
Si en una reacción en fase gaseosa los moles de los reactivos son iguales a los moles de los productos, los cambios en la presión no afectarán al equilibrio químico.
Reacción endotérmica
En una reacción endotérmica el calor puede considerarse como un reactivo, ya que es necesario su suministro para que ocurra la reacción:
A + Q ⇌ B
Q = calor suministrado
Por lo tanto, en una reacción endotérmica al aumentar la temperatura, el equilibrio se desplazará hacia la derecha. Mientras, al disminuir la temperatura, el equilibrio se desplaza hacia la izquierda.
Siendo el calor parte de los reactivos, A lo consumirá para transformarse en B.
Reacción exotérmica
En una reacción exotérmica se genera calor, siendo este un producto de la reacción:
A ⇌ B + Q
En una reacción exotérmica al aumentar la temperatura, el equilibrio se desplazará hacia la izquierda (reactivos), ya que aumenta la producción de calor. Mientras, al disminuir la temperatura, el equilibrio se desplazará hacia la derecha (productos).
Siendo el calor parte de los productos, al incrementarse la temperatura no habrá necesidad de aportar más calor al medio. Y por lo tanto, el equilibrio buscará aprovechar el calor extra para producir más reactivos; en este caso, más de A.
Dependiendo del estado físico de los componentes de la reacción, el equilibrio químico puede ser homogéneo o heterogéneo.
En este tipo de equilibrio, todos los reactivos y productos tienen la misma fase o estado líquido. Por ejemplo:
N2(g) + 3 H2(g) ⇌ 2 NH3(g)
Aquí tanto el N2, como el H2 y el NH3 son sustancias gaseosas.
Existe cuando no todos los reactivos y productos tienen la misma fase o estado físico. Por ejemplo:
2 NaHCO3(s) ⇌ Na2CO3(s) + CO2(g) + H2O(g)
Aquí tenemos al NaHCO3 y Na2CO3 como sólidos, y al CO2 y H2O como gases o vapores.
El ácido acético, CH3COOH, se disocia en agua estableciendo un equilibrio:
CH3COOH(ac) + H2O(l) ⇌ CH3COO–(ac) + H3O+(ac)
Reacción cuya constante de equilibrio se llama constante de acidez.
El gas n-butano puede isomerizarse de acuerdo a la siguiente reacción reversible para producir el isómero isobutano:
CH3CH2CH2CH3(g) ⇌ CH3CH(CH3)2(g)
En la atmósfera el óxido nítrico puede formarse, aunque muy escasamente, a partir del nitrógeno y el oxígeno del aire:
N2(g) + O2(g) ⇌ 2NO(g)
La Keq de esta reacción es 2·10-31 a 25 ºC, por lo que apenas se formará una cantidad despreciable de NO.
Los iones de plata, Ag+, pueden acomplejarse con el amoníaco de acuerdo a la siguiente reacción reversible:
Ag+(sol) + 2NH3(l) ⇌ [Ag(NH3)2]+(sol)
¿Qué tipo de equilibrio químico corresponde para la siguiente reacción?
2NOCl(g) ⇌ 2NO(g) + Cl2(g)
Esta reacción corresponde a un equilibrio de tipo homogéneo, ya que todas las sustancias involucradas, NOCl, NO y Cl2, son gases.
Para la misma reacción de arriba, ¿qué cambio en el equilibrio cabría esperarse si la presión de pronto se incrementara?
Contemos los moles de los reactivos:
2NOCl
Tenemos 2 moles de NOCl. Ahora contemos los moles de los productos:
2NO + Cl2
Tenemos tres moles: dos de NO, y uno de Cl2. Hay más moles gaseosos en el lado de los productos. Por lo tanto, un incremento de la presión ocasionará que el equilibrio se desplace hacia el lado izquierdo, hacia la formación de NOCl. De esta manera, el sistema busca suavizar los efectos de la presión favoreciendo la formación de NOCl y no de NO y Cl2.
Para la misma reacción de arriba, supóngase que se inyecta de repente un volumen considerable de Cl2. ¿Qué le ocurrirá al equilibrio?
Al añadirse Cl2 al reactor o recipiente, está aumentando su concentración como producto de la reacción. Y por lo tanto, el equilibrio se desplazará otra vez hacia la izquierda, para formar así más NOCl.
Si la disociación del NOCl a 227 ºC tiene una constante de equilibrio de 4.5·10-4, ¿hacia qué dirección se encuentra desplazado el equilibrio?
Nuevamente, al ser Keq menor que 1 (4.5·10-4 1), en el equilibrio se espera que haya más NOCl que NO o Cl2, ya que está desplazado hacia la izquierda.
De acuerdo a la siguiente reacción en equilibrio:
[Co(OH2)6]2+(ac) + 4Cl–(ac) + Q ⇌ [CoCl4]2-(ac) + 6H2O(l)
Y sabiendo que el complejo [Co(OH2)6]2+ es de color rosado, y que el complejo es [CoCl4]2- es azulado, ¿qué cambios esperaría observar si calienta un recipiente con [Co(OH2)6]2+? ¿Qué esperaría observar si luego de calentar el recipiente lo colocara en un baño con hielo?
La reacción es endotérmica, pues absorbe calor Q como reactivo. Por lo tanto, al calentar el recipiente con [Co(OH2)6]2+, el equilibrio se desplazará hacia la derecha, hacia la formación de [CoCl4]2-. Se verá un cambio de coloración de rosado a azulado.
Luego, si el recipiente de coloración azulada con [CoCl4]2- se coloca en un baño con hielo, la reacción se desplazará ahora hacia la izquierda, hacia la formación de Co(OH2)6]2+:
[CoCl4]2-(ac) + 6H2O(l) ⇌ [Co(OH2)6]2+(ac) + 4Cl–(ac) + Q
Esto se debe a que la reacción inversa es exotérmica, teniendo el calor Q como producto. Por lo tanto, al enfriar el recipiente con [CoCl4]2- de color azul, se formará otra vez el complejo [Co(OH2)6]2+, y el color rosado reaparecerá.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- eMedical Prep. (s.f.). Types of Equilibrium. Recuperado de: emedicalprep.com
- Lumen Boundless Chemistry. (s.f.). Factors that Affect Chemical Equilibrium. Recuperado de: courses.lumenlearning.com
- Wikipedia. (2020). Chemical equilibrium. Recuperado de: en.wikipedia.org
- Chemistry LibreTexts. (24 de mayo de 2020). Equilibrium Calculations – Some Illustrative Examples. Recuperado de: chem.libretexts.org
- Meyers Amy. (2020). Equilibrium: Chemical and Dynamic. Study. Recuperado de: study.com
- Helmenstine, Anne Marie, Ph.D. (11 de febrero de 2020). Chemical Equilibrium in Chemical Reactions. Recuperado de: thoughtco.com
