Peróxido de bario (BaO2): estructura, propiedades y usos
El peróxido de bario es un compuesto iónico e inorgánico cuya fórmula química es BaO2. Al tratarse de un compuesto iónico, consiste en iones Ba2+ y O22-; este último es el que se conoce como anión peróxido, y a causa de él el BaO2 adquiere su nombre. Siendo así, el BaO2 es un peróxido inorgánico.
Las cargas de sus iones dejan entrever cómo se forma este compuesto a partir de los elementos. El metal bario, del grupo 2, cede dos electrones a la molécula de oxígeno, O2, cuyos átomos no los utilizan para reducirse a los aniones óxidos, O2-, sino para mantenerse unidos por un enlace simple, [O-O]2-.

El peróxido de bario es un sólido granular a temperatura ambiente, de color blanco con ligeras tonalidades grisáceas (imagen superior). Como casi todos los peróxidos, debe manipularse y almacenarse con cuidado, ya que puede acelerar la oxidación de ciertas sustancias.
De todos los peróxidos formados por los metales del grupo 2 (Sr. Becambara), el BaO2 es termodinámicamente el más estable frente a su descomposición térmica. Cuando se calienta, libera oxígeno y se produce óxido de bario, BaO. El BaO puede reaccionar con el oxígeno del ambiente, a altas presiones, para formar nuevamente el BaO2.
Índice del artículo
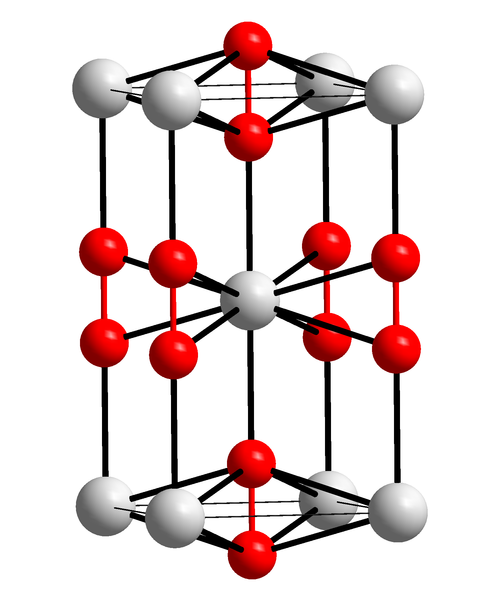
En la imagen superior se muestra la celda unitaria tetragonal del peróxido de bario. Dentro de ella pueden verse los cationes Ba2+ (esferas blancas), y los aniones O22- (esferas rojas). Noten que las esferas rojas están unidas por un enlace simple, por lo que representan la geometría lineal [O-O]2-.
A partir de esta celda unitaria, se pueden construir los cristales de BaO2. Si se observa, el anión O22- se ve que está rodeado por seis Ba2+, obteniéndose un octaedro cuyos vértices son blancos.
Por otro lado, aún más evidente, cada Ba2+ está rodeado de diez O22- (esfera blanca del centro). Todo el cristal consiste de este orden constante a corto y largo alcance.
Si además se observan las esferas blancas rojas, se notará que no difieren demasiado en sus tamaños o radios iónicos. Esto se debe a que el catión Ba2+ es muy voluminoso, y sus interacciones con el anión O22- estabilizan en mejor grado la energía reticular del cristal en comparación a como lo harían, por ejemplo, los cationes Ca2+ y Mg2+.
Asimismo, esto explica por qué el BaO es de los óxidos alcalinotérreos el más inestable: los iones Ba2+ y O2- difieren considerablemente de tamaño, desestabilizando sus cristales.
Como es más inestable, menor es la tendencia del BaO2 en descomponerse para formar el BaO; al contrario de los peróxidos SrO2, CaO2 y MgO2, cuyos óxidos son más estables.
El BaO2 puede hallarse en forma de hidratos, de los cuales el BaO2∙8H2O es el más estable de todos; y de hecho, este es el que se comercializa, en lugar del peróxido de bario anhidro. Para obtener el anhidro, debe secarse a 350°C el BaO2∙8H2O, con el propósito de eliminarle el agua.
Su estructura cristalina también es tetragonal, pero con ocho moléculas de H2O interaccionando con los O22- mediante puentes de hidrógeno, y con los Ba2+ mediante interacciones dipolo-ion.
Otros hidratos, de cuyas estructuras no hay mucha información al respecto, son: BaO2∙10H2O, BaO2∙7H2O y BaO2∙H2O.
La preparación directa del peróxido de bario consiste en la oxidación de su óxido. Este puede emplearse desde el mineral barita, o desde la sal nitrato de bario, Ba(NO3)2; ambos se someten a calentamiento en una atmósfera de aire o enriquecida con oxígeno.
Otro método consiste en hacer reaccionar en un medio acuoso frío el Ba(NO3)2 con el peróxido de sodio:
Ba(NO3)2 + Na2O2 + xH2O => BaO2∙xH2O + 2NaNO3
Luego el hidrato BaO2∙xH2O se somete a calentamiento, se filtra y termina por secarse empleando vacío.
Es un sólido blanco que puede tornarse grisáceo si presenta impurezas (ya sea de BaO, Ba(OH)2, u otras especies químicas). Si se calienta a una temperatura muy alta, desprenderá llamas verdosas, debido a las transiciones electrónicas de los cationes Ba2+.
169,33 g/mol.
5,68 g/mL.
450°C.
800°C. Este valor concuerda con lo que debe esperarse de un compuesto iónico; y aún más, del peróxido alcalinotérreo más estable. Sin embargo, realmente no hierve el BaO2, sino que se desprende oxígeno gaseoso producto de su descomposición térmica.
Insoluble. Sin embargo, lentamente puede sufrir hidrólisis para producir peróxido de hidrógeno, H2O2; y además, su solubilidad en medio acuoso aumenta si se añade un ácido diluido.
La siguiente ecuación química muestra la reacción de descomposición térmica que sufre el BaO2:
2BaO2 => 2BaO + O2
La reacción es de una sola dirección si la temperatura es superior a los 800°C. Si acto seguido se aumenta la presión y disminuye la temperatura, todo el BaO se transformará nuevamente en BaO2.
Otra manera para nombrar al BaO2 es peróxido bárico, de acuerdo a la nomenclatura tradicional; ya que el bario solo puede tener en sus compuestos la valencia +2.
Equivocadamente, se emplea la nomenclatura sistemática para referirse a él como dióxido (binóxido) de bario, considerándole un óxido y no un peróxido.
Haciendo uso del mineral barita (BaO), se calienta con corrientes de aire para eliminarles su contenido de oxígeno, a una temperatura alrededor de los 700°C.
Si al peróxido resultante se le somete a un calentamiento tenue, bajo vacío, el oxígeno se regenera con mayor rapidez y la barita puede reutilizarse indefinida veces para almacenar y producir oxígeno.
Este proceso se ideó comercialmente por L. D. Brin, hoy en día obsoleto.
El peróxido de bario reacciona con ácido sulfúrico para producir peróxido de hidrógeno:
BaO2 + H2SO4 => H2O2 + BaSO4
Es por lo tanto una fuente de H2O2, manipulado sobretodo con su hidrato BaO2∙8H2O.
De acuerdo a estos dos usos mencionados, el BaO2 permite el desarrollo de O2 y H2O2, ambos agentes oxidantes, en síntesis orgánicas y en procesos de blanqueamiento en la industria textil y de colorantes. Asimismo, es un buen agente desinfectante.
Además, a partir del BaO2 pueden sintetizarse otros peróxidos, como el de sodio, Na2O2, y otras sales de bario.
- S.C. Abrahams, J Kalnajs. (1954). The crystal structure of barium peroxide. Laboratory for Insulation Research, Massachusetts Institute of Technology, Cambridge, Massachusetts, U.S.A.
- Wikipedia. (2018). Barium peroxide. Recuperado de: en.wikipedia.org
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Atomistry. (2012). Barium peroxide. Recuperado de: barium.atomistry.com
- Khokhar y col. (2011). Study of Laboratory Scale Preparation and Development of a Process for Barium Peroxide. Recuperado de: academia.edu
- PubChem. (2019). Barium peroxide. Recuperado de: pubchem.ncbi.nlm.nih.gov
- PrebChem. (2016). Preparation of barium peroxide. Recuperado de: prepchem.com
