Óxido de bario (BaO): estructura, propiedades, usos, riesgos
El óxido de bario es un sólido inorgánico formado por un átomo de bario (Ba) y un átomo de oxígeno (O). Su fórmula química es BaO. Es un sólido cristalino blanco y es higroscópico, es decir, absorbe humedad del aire, pero al hacerlo reacciona con esta.
La rápida reacción del óxido de bario con el agua hace que sea usado en laboratorios de análisis químico para desecar, o sea, eliminar agua de solventes orgánicos, que son compuestos líquidos que sirven para disolver otras sustancias.

El BaO se comporta como una base fuerte, por lo tanto reacciona con muchos tipos de ácidos. Por ejemplo reacciona fácilmente con el dióxido de carbono CO2 del aire para formar carbonato de bario BaCO3.
Sirve en la fabricación de los polímeros para cables de electricidad y como ingrediente para resinas para sellar orificios de dientes que han sido curados.
El óxido de bario (BaO) también es empleado en la industria de la cerámica, tanto para recubrirla con vidriado como para fabricarla. Además se utiliza en mezclas de cemento para incrementar la resistencia a la compresión del producto final.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades físicas
- 4 Propiedades químicas
- 5 Riesgos
- 6 Obtención
- 7 Usos
- 8 Referencias
El óxido de bario BaO está formado por un catión Ba2+ y un anión oxígeno O2–.
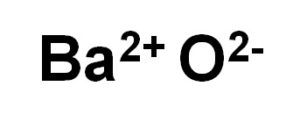
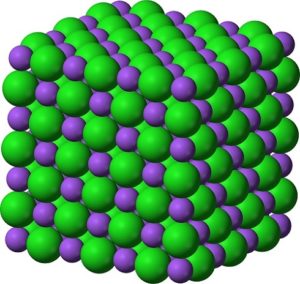
En sus cristales el BaO forma redes iónicas cúbicas (en forma de cubo) del tipo cloruro de sodio.
La configuración electrónica del ion bario es: [Xe] 6s0 pues ha perdido los dos electrones de la capa 6s. Esta configuración es muy estable.
-Óxido de bario
-Monóxido de bario
Sólido cristalino color blanco amarillento.
153,33 g/mol
1923 ºC
Aproximadamente 2000 ºC.
5,72 g/cm3
Poco soluble en agua: 3,8 g/100 mL a 20 ºC.
El óxido de bario BaO reacciona rápidamente con el agua desprendiendo calor y formando una solución corrosiva de hidróxido de bario Ba(OH)2, que es el hidróxido más soluble entre los hidróxidos de metales alcalinotérreos.
BaO + H2O → Ba(OH)2
El BaO es una base fuerte. Reacciona de forma exotérmica (es decir, con desprendimiento de calor) con todo tipo de ácidos.
Con CO2 el BaO reacciona para formar carbonato de bario BaCO3.
BaO + CO2 → BaCO3
El BaO es higroscópico, porlo que si se deja expuesto al ambiente se une poco a poco a la humedad del aire, formando Ba(OH)2 el cual se combina con el dióxido de carbono CO2 del aire para dar carbonato de bario BaCO3.
Cuando se calienta el monóxido de bario BaO en presencia de aire se combina con el oxígeno formando peróxido de bario BaO2. La reacción es reversible.
2 BaO + O2 ⇔ 2 BaO2
En presencia de agua puede reaccionar con aluminio Al o con cinc Zn formando los óxidos o hidróxidos de dichos metales y generando gas hidrógeno H2.
Puede iniciar la polimerización de compuestos orgánicos susceptibles de polimerizar, como los epóxidos.
Puede ser tóxico por ingestión. No debe entrar en contacto con la piel. Es irritante de los ojos, piel y tracto respiratorio. Puede ser dañino para el sistema nervioso. Es capaz de causar bajos niveles de potasio, lo que resulta en desórdenes cardíacos y musculares.
El óxido de bario BaO se puede obtener calentando el carbonato de bario BaCO3 con carbón. Se forma el BaO y se desprende gas de monóxido de carbono CO.
BaCO3 + C → BaO + 2 CO↑
Por su facilidad para reaccionar con agua el BaO se ha usado desde mediados del siglo pasado como desecante para gasolina y solventes orgánicos básicos o neutros.
El BaO es muy activo secando a su alrededor, toma la humedad con mucha rapidez, con evolución de bastante calor, formando hidróxido de bario Ba(OH)2 el cual es estable hasta unos 1000 ºC. Por ello el BaO se puede emplear a altas temperaturas.
Además tiene una alta capacidad de absorción de agua. Por cada molécula de BaO se puede absorber una de agua y el Ba(OH)2 resultante también puede absorber cierta cantidad de agua.
Es adecuado para los laboratorios de química analítica. No es pegajoso.
Se puede usar en desecadores, que son grandes recipientes de vidrio con tapa donde se mantiene el ambiente interno seco. El BaO mantiene seca la miniatmósfera del desecador.

Estos desecadores sirven para colocar sustancias o reactivos y así evitar que absorban agua del ambiente.
También sirve para secar gases básicos como por ejemplo el amoníaco NH3.
El BaO se coloca en los electrodos de las lámparas de descarga como material emisor de electrones.
Las lámparas de descarga están formadas por un tubo de vidrio, cuarzo u otro material adecuado, contienen un gas inerte y en la mayoría de los casos un vapor de metal. El vapor metálico puede ser de sodio o de mercurio.

En el interior del tubo ocurren descargas eléctricas debido a que posee un electrodo positivo y uno negativo.
El BaO es colocado en los electrodos de la lámpara. Los electrones que emite chocan con los átomos del vapor del metal y les transmite energía.
Al pasar una corriente eléctrica a través de este gas o vapor se produce luz visible o radiación ultravioleta (UV).
El BaO se utiliza en composiciones de recubrimiento vidriado de cerámica.
Sin embargo, también ha sido probado como aditivo en la preparación de vitrocerámica.
El BaO mejora de forma efectiva las características mecánicas y la resistencia química de este tipo de cerámica. Tiene una fuerte influencia en las propiedades térmicas y la composición de la fase cristalina de los materiales obtenidos.
Se ha probado el BaO como componente del cemento de fosfoaluminato.
Este tipo de cemento es útil en ambientes marinos, ya que no tiene la misma tendencia a hidratarse que otros tipos de cemento, por lo que no sufre formación de poros ni expansiones.
Sin embargo, los cementos de fosfoaluminato requieren ser fortalecidos en su desempeño mecánico para poder soportar las corrientes marinas y golpes de trozos flotantes de hielo presentes en el océano.
La adición de BaO al cemento de fosfoaluminato modifica la estructura mineral de dicho material, mejora la estructura de los poros y aumenta considerablemente la fuerza compresiva de la pasta del cemento.
En otras palabras, el BaO mejora la resistencia a la compresión de este tipo de cemento.

Se emplea como ingrediente para proporcionar opacidad en resinas dentales para el relleno de orificios en los dientes, realizado por odontólogos.
También se utiliza como agente de nucleación para la preparación de polímeros de fluoruro de polivinilideno que se usan para aislar cables de electricidad.
- Partyka, J. et al. (2016). Effect of addition of BaO on sintering of glass-ceramic materials from SiO2-Al2O3-Na2O-K2O-CaO/MgO system. J Therm Anal Calorim (2016) 125:1095. Recuperado de link.springer.com.
- Zhang, P. et al. (2019). Effect of BaO on mineral structure and hydration behavior of phosphoaluminate cement. J Therm Anal Calorim (2019) 136:2319. Recuperado de link.springer.com.
- U.S. National Library of Medicine. (2019). Barium oxide. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Smith, N.A. (2003). Lighting. Principle. In Electrical Engineer’s Reference Book (Sixteenth Edition). Recuperado de sciencedirect.com.
- Ebnesajjad, S. (2003). Fluoropolymer Foams. Foaming PVDF. In Melt Processible Fluoroplastics. Recuperado de sciencedirect.com.
- Booth, H.S. and McIntyre, L.H. (1930). Barium Oxide as a Dessicant. Ind. Eng. Chem. Anal. Ed. 1930, 2, 1, 12-15. Recuperado de pubs.acs.org.
