Yodo: historia, propiedades, estructura, obtención, riesgos, usos
El yodo es un elemento no metálico reactivo que pertenece al grupo 17 de la tabla periódica (halógenos) y viene representado por el símbolo químico I. En esencia es un elemento bastante conocido a nivel popular, desde el agua yodada, hasta la hormona de tirosina.
En estado sólido el yodo es de color gris oscuro con un lustre metálico (imagen inferior), capaz de sublimarse para producir un vapor de color violeta el cual, al condensarse sobre una superficie fría, deja un residuo oscuro. Numerosos y atractivos han sido los experimentos para demostrar estas características.

Este elemento fue aislado por vez primera por Bernard Curtois en el año de 1811, mientras obtenía compuestos que servían de materia prima para la fabricación del salitre. Sin embargo, Curtois no identificó el yodo como un elemento, mérito que compartieron Joseph Gay-Lussac y Humphry Davy. Gay-Lussac identificó al elemento como “iode”, término que provenía de la palabra griega “ioides” con la que se designaba el color violeta.
El yodo elemental, al igual que los otros halógenos, es una molécula diatómica, formada por dos átomos de yodo unidos por un enlace covalente. La interacción de Van der Waals entre las moléculas de yodo es la más fuerte entre los halógenos. Esto explica por qué el yodo es el halógeno con los puntos de fusión y ebullición más altos. Además, es el menos reactivo de los halógenos, y el que tiene menor electronegatividad.
El yodo es un elemento esencial que requiere ser ingerido, ya que es necesario para el crecimiento corporal; el desarrollo cerebral y mental; el metabolismo en general, etc., recomendándose una ingesta diaria de 110 µg/día.
La deficiencia del yodo en estado fetal de una persona está asociada a la aparición del cretinismo, condición caracterizada por enlentecimiento del crecimiento corporal; así como desarrollo mental e intelectual insuficiente, estrabismo, etc.
Mientras, una deficiencia de yodo a cualquier edad del individuo está asociada a la aparición de un bocio, caracterizado por una hipertrofia de la tiroides. El bocio es una enfermedad endémica, ya que se encuentra confinada a ciertas áreas geográficas con características alimenticias propias.
Índice del artículo
- 1 Historia
- 2 Propiedades físicas y químicas
- 2.1 Apariencia
- 2.2 Peso atómico estándar
- 2.3 Número atómico (Z)
- 2.4 Punto de fusión
- 2.5 Punto de ebullición
- 2.6 Densidad
- 2.7 Solubilidad
- 2.8 Olor
- 2.9 Coeficiente de partición octanol/agua
- 2.10 Descomposición
- 2.11 Viscosidad
- 2.12 Punto triple
- 2.13 Punto crítico
- 2.14 Calor de fusión
- 2.15 Calor de vaporización
- 2.16 Capacidad calórica molar
- 2.17 Presión de vapor
- 2.18 Números de oxidación
- 2.19 Electronegatividad
- 2.20 Energía de ionización
- 2.21 Conductividad térmica
- 2.22 Resistividad Eléctrica
- 2.23 Orden magnética
- 2.24 Reactividad
- 3 Estructura y configuración electrónica
- 4 Dónde se encuentra y obtención
- 5 Papel biológico
- 6 Riesgos
- 7 Usos
- 8 Referencias
El yodo fue descubierto por el químico francés Bernard Curtois, en el año de 1811, mientras trabajaba con su padre en la producción de salitre, requiriéndose para ello de carbonato de sodio.
Este compuesto se aislaba de algas marinas que recolectaban en las costas de Normandía y Bretaña. Con este fin, se quemaban las algas y se lavaban las cenizas con agua, destruyéndose los residuos resultantes con la adición de ácido sulfúrico.
En cierta ocasión, quizás por un error fortuito, Curtois añadió un exceso de ácido sulfúrico y se formó un vapor púrpura que cristalizaba sobre las superficies frías, depositándose como cristales oscuros. Curtois sospechaba que estaba en presencia de un nuevo elemento y lo llamó “Sustancia X”.
Curtois descubrió que esta sustancia cuando se mezclaba con amoníaco formaba un sólido de color marrón (triyoduro de nitrógeno) que explotaba al mínimo contacto.
Sin embargo, Curtois tenía limitaciones para continuar su investigación y decidió entregar muestras de su sustancia a Charles Desormes, Nicolas Clément, Joseph Gay-Lussac y André-Marie Ampère, con el fin de obtener su colaboración.
En noviembre de 1813, Desormes y Clément hicieron público el descubrimiento de Curtois. En diciembre de ese mismo año, Gay-Lussac señaló que la nueva sustancia podría ser un nuevo elemento, sugiriéndole el nombre de “iode” proveniente de la palabra griega “ioides”, designada para el violeta.
Sir Humphry Davy, quien recibió una porción de la muestra entregada a Ampère por Curtois, hizo experimentos con la muestra y notó una similitud con el cloro. En diciembre de 1813, le participó a la Royal Society of London la identificación de un nuevo elemento.
Aunque surgió una discusión entre Gay-Lussac y Davy acerca de la identificación del yodo, ambos reconocieron que fue Curtois el primero que lo había aislado. En 1839 finalmente Curtois recibió el Premio Montyn de la Royal Academy of Sciences como reconocimiento al aislamiento del yodo.
En 1839, Louis Daguerre le dio al yodo su primer uso comercial, mediante la invención de un método para producir imágenes fotográficas llamadas daguerrotipos, en láminas delgadas de metal.
En 1905, el patólogo norteamericano David Marine, investigó la deficiencia de yodo en ciertas enfermedades y recomendó su ingesta.

Sólido gris oscuro de lustre metálico. Cuando sublima sus vapores son de coloración violeta (imagen superior).
126,904 u
53
113,7 ºC
184,3 ºC
Temperatura ambiente: 4,933 g/cm3
En el agua se disuelve para originar disoluciones marrones de una concentración de 0,03% a 20 ºC.
Esta solubilidad se incrementa considerablemente si hay iones yoduros previamente disueltos, pues se establece un equilibrio entre el I– y I2 para formar la especie aniónica I3–, la cual se solvata mejor que el yodo.
En solventes orgánicos como el cloroformo, tetracloruro de carbono y disulfuro de carbono, el yodo se disuelve dando una coloración púrpura. Asimismo, se disuelve en los compuestos nitrogenados, tales como piridina, quinolina y amoníaco, para formar una solución de color marrón, nuevamente.
La diferencia de las coloraciones radica en el hecho de que el yodo esté disuelto como moléculas solvatadas I2, o como complejos de transferencias de carga; estos últimos aparecen cuando se tratan de solventes polares (el agua entre ellos), los cuales se comportan como bases de Lewis al donarle electrones al yodo.
Acre, irritante y característico. Umbral de olor: 90 mg/m3 y umbral de olor irritante: 20 mg/m3.
Log P = 2,49
Cuando es calentado a descomposición emite un humo de yoduro de hidrógeno y varios compuestos de yoduro.
2,27 cP a 116 ºC
386,65 K y 121 kPa
819 K y 11,7 MPa
15,52 kJ/mol
41,57 kJ/mol
54,44 J/(mol·K)
El yodo tiene una presión de vapor moderada y cuando se abre el recipiente que lo contiene se sublima lentamente a un vapor violeta, irritante para los ojos, la nariz y la garganta.
Los números de oxidación para el yodo son: –1 (I–), +1 (I+), +3 (I3+), +4 (I4+), +5 (I5+), +6 (I6+) y +7 (I7+). En todas las sales de yoduro, como el caso del KI, el yodo se encuentra con un número de oxidación de -1, pues en ellas tenemos al anión I–.
El yodo adquiere números de oxidación positivos cuando se combina con elementos más electronegativos que él; por ejemplo, en sus óxidos (I2O5 y I4O9) o compuestos interhalogenados (I-F, I-Cl y I-Br).
2,66 en la escala de Pauling
Primera: 1.008,4 kJ/mol
Segunda: 1.845 kJ/mol
Tercera: 3.180 KJ/mol
0,449 W/(m·K)
1,39·107 Ω·m a 0 ºC
Diamagnética
El yodo se combina con la mayoría de los metales para formar yoduros, y también con elementos no metálicos como el fósforo y otros halógenos. El ion yoduro es un agente reductor fuerte, el cual libera espontáneamente un electrón. La oxidación del yoduro produce un tinte parduzco de yodo.
El yodo, por el contrario del yoduro, es un agente oxidante débil; más débil que el bromo, el cloro y el flúor.
El yodo con número de oxidación +1 puede combinarse con otros halógenos con número de oxidación -1, para originar los haluros de yodo; por ejemplo: el bromuro de yodo, IBr. Asimismo, se combina con el hidrógeno para originar el yoduro de hidrógeno, el cual tras disolverse en agua se denomina ácido yodhídrico.
El ácido yodhídrico es un ácido muy fuerte capaz de formar yoduros por reacción con los metales o sus óxidos, hidróxidos y carbonatos. El yodo posee un estado de oxidación +5 en el ácido yódico (HIO3), el cual se deshidrata para producir el pentóxido de yodo (I2O5).

El yodo en su estado basal consiste de un átomo que posee siete electrones de valencia, a solo uno de poder completar su octeto y volverse isoelectrónico con el gas noble xenón. Estos siete electrones se disponen en sus orbitales 5s y 5p de acuerdo a su configuración electrónica:
[Kr] 4d10 5s2 5p5
Por lo tanto, los átomos I muestran una fuerte tendencia a enlazarse covalentemente para que cada uno individualmente tenga ocho electrones en su capa más externa. Así, dos átomos I se aproximan y forman el enlace I-I, el cual define la molécula diatómica I2 (imagen superior); unidad molecular del yodo en sus tres estados físicos en condiciones normales.
En la imagen se observa la molécula I2 representada por un modelo de llenado espacial. No solo es una molécula diatómica, sino además homonuclear y apolar; por lo que sus interacciones intermoleculares (I2 — I2) vienen regidas por las fuerzas de dispersión de London, las cuales son directamente proporcionales a su masa molecular y al tamaño de los átomos.
Este enlace I-I, sin embargo, es más débil en comparación al de los otros halógenos (F-F, Cl-Cl y Br-Br). Esto se debe en teoría al pobre traslape de sus orbitales híbridos sp3.
La masa molecular del I2 permite que sus fuerzas dispersivas sean lo suficientemente direccionales y fuertes para establecer un cristal ortorrómbico a presión ambiente. Su alto contenido en electrones hace que la luz promueva sinfines de transiciones energéticas, lo cual produce que los cristales de yodo se tiñan de negro.
No obstante, cuando el yodo sublima sus vapores exhiben una coloración violeta. Esto es indicativo ya de una transición más específica dentro de los orbitales moleculares del I2 (los de mayor energía o de antienlace).
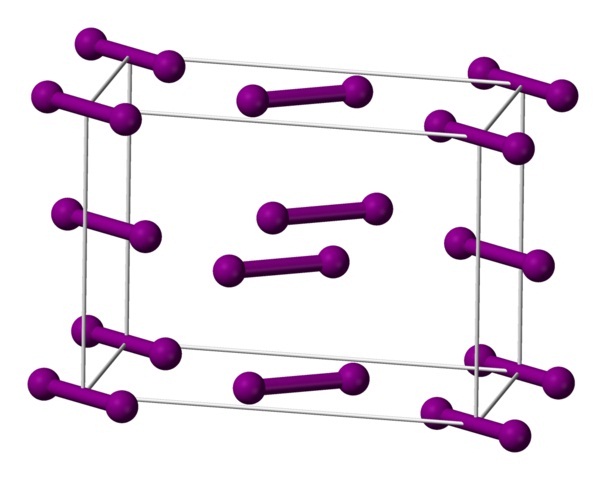
Arriba se muestran las moléculas I2, representadas por un modelo de esferas y barras, ordenadas dentro de la celda unitaria ortorrómbica.
Puede observarse que hay dos capas: la del abajo con cinco moléculas, y la del medio con cuatro. Nótese además que una molécula de yodo se sitúa en la base de la celda. El cristal se construye distribuyendo periódicamente estas capas en las tres dimensiones.
Recorriendo la dirección paralela a los enlaces I-I, se encuentra que los orbitales de yodo se solapan para generar una banda de conducción, la cual vuelve a este elemento un semiconductor; sin embargo, su capacidad de conducir la electricidad desaparece si se sigue la dirección perpendicular a las capas.
Distancias de enlace
El enlace I-I pareciera haberse dilatado; y de hecho así es, pues la longitud de su enlace se incrementa de 266 pm (estado gaseoso), a 272 pm (estado sólido).
Esto puede deberse a que en el gas las moléculas I2 se hallan muy distanciadas, siendo casi despreciables sus fuerzas intermoleculares; mientras que en el sólido, estas fuerzas (I-I — I-I) se vuelven tangibles, atrayendo los átomos de yodo de dos moléculas vecinas hacia sí y acortando en consecuencia la distancia intermolecular (o interatómica, vista de otro modo).
Entonces, cuando el cristal de yodo sublima, el enlace I-I se contrae en la fase gaseosa, pues las moléculas vecinas ya no ejercen la misma fuerza de atracción (dispersiva) sobre sus alrededores. Y además, lógicamente, la distancia I2 — I2 aumenta.
Se mencionó anteriormente que el enlace I-I es más débil en comparación al de los otros halógenos. En fase gaseosa a una temperatura de 575 ºC, el 1% de las moléculas I2 se disgregan en átomos I individuales. Hay tanta energía térmica que apenas dos I vuelven a unirse se separan, y así sucesivamente.
Similarmente puede ocurrir este rompimiento de enlace si se aplica enormes presiones sobre los cristales de yodo. Al comprimirlo demasiado (bajo una presión cientos de miles de veces superior a la atmosférica), las moléculas I2 se reordenan como una fase monoatómica I, y se dice entonces que el yodo exhibe características metálicas.
No obstante, existen otras fases cristalinas, tales como: la ortorrómbica centrada en el cuerpo (fase II), la tetragonal centrada en el cuerpo (fase III) y la cúbica centrada en las caras (fase IV).
El yodo tiene una proporción en peso, en relación a la corteza terrestre, del 0,46 ppm, ocupando el lugar 61 en abundancia en ella. Los minerales de yoduros son escasos, y los depósitos de yodo que son explotables comercialmente son de yodatos.
Los minerales de yodo en encuentran en rocas ígneas con una concentración de 0,02 mg/kg a 1,2 mg/kg, y en rocas magmáticas con una concentración de 0,02 mg a 1,9 mg/kg. También puede encontrarse en la Kimmeridge lutita, con una concentración de 17 mg/kg de peso.
Además, los minerales de yodo se encuentran en las rocas de fosfato con una concentración que oscila entre 0,8 y 130 mg/kg. El agua de mar tiene una concentración de yodo que varía de 0,1 a 18 µg/L. Las algas, esponjas y ostras marinas fueron antiguamente las fuentes principales de yodo.
Actualmente sin embargo las fuentes principales son el caliche, depósitos de nitrato de sodio en el desierto de Atacama (Chile), y las salmueras, principalmente las del campo de gas japonés en Minami Kanto, al este de Tokio, y el campo de gas Anadarko Basin en Oklahoma (USA).
El yodo es extraído del caliche en forma de yodato y se trata con bisulfito de sodio para reducirlo a yoduro. Luego, la solución se hace reaccionar con yodato recién extraído para facilitar su filtración. El caliche fue la principal fuente de yodo en el siglo XIX y comienzos del siglo XX.
Después de su purificación, la salmuera se trata con ácido sulfúrico, lo cual produce yoduro.
Esta disolución de yoduros posteriormente se hace reaccionar con cloro para producir una solución diluida de yodo, el cual se evapora mediante una corriente de aire que es desviada a una torre absorbente de dióxido de azufre, produciéndose la reacción siguiente:
I2 + 2 H2O + SO2 => 2 HI + H2SO4
Posteriormente, el gas yoduro de hidrógeno reacciona con cloro para liberar el yodo en estado gaseoso:
2 HI + Cl2 => I2 + 2 HCl
Y finalmente, el yodo se filtra, purifica y envasa para su uso.
El yodo es un elemento esencial, ya que interviene en numerosas funciones en los seres vivos, las cuales son especialmente conocidas en los seres humanos. La única vía de ingreso del yodo al hombre son los alimentos que este ingiere.
La dieta recomendada de yodo varía con la edad. Así un niño de 6 meses requiere una ingesta de 110 µg/día; pero a partir de los 14 años, la dieta recomendada es de 150 µg/día. Además, se señala que la ingesta de yodo no debe sobrepasar 1.100 µg/día.
La hormona estimulante de la tiroides (TSH) es secretada por la hipófisis y estimula la captación de yodo por los folículos tiroideos. El yodo se lleva al interior de los folículos tiroides, conocidos como coloides, donde se une al aminoácido tirosina para formar la monoyodotirosina y la diyodotirosina.
En el coloide folicular, una molécula de monoyodotirosina se combina con una molécula de diyodotirosina para formar una molécula llamada triyodotironina (T3). Por otro lado, se pueden unir dos moléculas de diyodotirosina, formando la tetrayodotironina (T4). La T3 y la T4 son las llamadas hormonas tiroideas.
Las hormonas T3 y T4 son secretadas al plasma donde se unen a proteínas plasmáticas; entre ellas la proteína transportadora de las hormonas tiroideas (TBG). La mayor parte de las hormonas tiroideas se transportan en el plasma como T4.
Sin embargo, la forma activa de las hormonas tiroideas es la T3, por lo que la T4 en los “órganos blancos” de las hormonas tiroideas, experimenta una desyodinación y se transforma en T3 para ejercer su acción hormonal.
Efectos
Los efectos de la acción de las hormonas tiroideas son múltiples, pudiéndose señalar las siguientes: aumento del metabolismo y la síntesis de proteínas; promoción del crecimiento corporal y el desarrollo cerebral; aumento de la presión arterial y frecuencia cardíaca, etc.
La deficiencia de yodo y, por ende, de las hormonas tiroideas, conocida como hipotiroidismo, tiene numerosas consecuencias que están influenciadas por la edad de la persona.
Si la deficiencia de yodo ocurre durante el estado fetal de una persona, la consecuencia más relevante es el cretinismo. Esta condición se caracteriza por signos tales como deterioro de la función mental, retraso en el desarrollo físico, estrabismo y maduración sexual tardía.
Una deficiencia de yodo puede inducir un bocio, independientemente de la edad a la que ocurra la deficiencia. Un bocio es un desarrollo excesivo de la tiroides, causada por una estimulación excesiva de la glándula por la hormona TSH, liberada de la hipófisis como consecuencia de la deficiencia de yodo.
El tamaño excesivo de la tiroides (bocio) puede comprimir la tráquea, limitando el paso de aire a través de ella. Además, puede producir un daño a los nervios laríngeos que puede tener como consecuencia ronquera.
Un envenenamiento por una ingesta excesiva de yodo puede causar quemaduras en la boca, garganta y fiebre. También dolor abdominal, náusea, vómitos, diarrea, pulso débil y coma.
Un exceso de yodo produce algunos de los síntomas observados en una deficiencia: hay una inhibición de la síntesis de las hormonas tiroideas, por lo que aumenta la liberación de la TSH, lo cual trae como consecuencia una hipertrofia de la tiroides; es decir, un bocio.
Hay estudios que señalan que la ingesta excesiva de yodo puede causar tiroiditis y cáncer papilar de tiroides. Además, una ingesta excesiva de yodo puede interaccionar con medicamentos limitando su acción.
La ingesta excesiva de yodo conjuntamente con medicamentos antitiroideos, como el metimazol, utilizados para tratar el hipertiroidismo, puede tener un efecto aditivo y causar hipotiroidismo.
Los inhibidores de la enzima convertidora de la angiotensina (ECA), como benazepril, se usa en el tratamiento de la hipertensión. El tomar una cantidad excesiva de yoduro de potasio aumenta el riesgo de hipercalemia e hipertensión.
El yodo actúa como desinfectante de piel o de heridas. Tiene acción antimicrobiana casi instantánea, penetrando en el interior de los microorganismos e interaccionando con aminoácidos azufrados, nucleótidos y ácidos grasos, lo cual provoca la muerte celular.
Ejerce su acción antiviral fundamentalmente sobre los virus cubiertos, postulándose que ataca a las proteínas de la superficie de los virus cubiertos.
El yoduro de potasio en forma de solución concentrada, se utiliza en el tratamiento de la tirotoxicosis. También se usa para controlar los efectos de una radiación de 131I al bloquear la unión del isótopo radiactivo a la tiroides.
El yodo se usa en el tratamiento de la queratitis dendrítica. Para ello se expone la córnea a vapores de agua saturada con yodo, perdiéndose transitoriamente el epitelio de la córnea; pero hay una recuperación completa de ella en dos o tres días.
También el yodo tiene efectos beneficiosos en el tratamiento de la fibrosis quística del seno humano. Asimismo, se ha señalado que el 131I podría ser un tratamiento opcional del cáncer de tiroides.
El yodo se utiliza para detectar la presencia de almidón, dando una coloración azul. La reacción del yodo con el almidón se usa además para detectar la presencia de billetes falsos impresos en papel que contienen almidón.
El tetrayodomercurato de potasio (II), también conocido como reactivo de Nessler, se usa en la detección del amoníaco. Asimismo, una solución de yodo alcalino se utiliza en la prueba de yodoformo, para evidenciar la presencia de metilcetonas.
Los yoduros inorgánicos se utilizan en la purificación de metales, tales como titanio, circonio, hafnio y torio. En una etapa del proceso se deben formar los tetrayoduros de estos metales.
El yodo sirve como estabilizador para la colofonia, el aceite y otros productos de la madera.
El yodo se emplea como catalizador en las reacciones de síntesis orgánica de metilación, isomerización y deshidrogenación. Mientras, el ácido yodhídrico se usa como catalizador para la producción de ácido acético en los procesos de Monsanto y Cativa.
El yodo actúa como catalizador en la condensación y alquilación de aminas aromáticas, así como en procesos de sulfatación y sulfanación, y para la producción de cauchos sintéticos.
El yoduro de plata es un componente esencial de la película fotográfica tradicional. El yodo se utiliza en la fabricación de instrumentos electrónicos como prismas de cristal único, instrumentos ópticos polarizadores, y un vidrio capaz de transmitir rayos infrarrojos.
El yodo se emplea en la elaboración de pesticidas, colorantes de anilina y ftaleína. Además, se usa en la síntesis de tintes, y es un agente extintor de humo. Y por último, el yoduro de plata sirve como núcleo de condensación del vapor de agua en las nubes, con el fin de provocar la lluvia.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Stuart Ira Fox. (2003). Fisiología Humana. Primera Edición. Edit. McGraw-Hill Interamericana
- Wikipedia. (2019). Iodine. Recuperado de: en.wikipedia.org
- Takemura Kenichi, Sato Kyoko, Fujihisa Hiroshi & Onoda Mitsuko. (2003). Modulated structure of solid iodine during its molecular dissociation under high pressure. Nature volume 423, pages971–974. doi.org/10.1038/nature01724
- Chen L. et al. (1994). Structural Phase Transitions of Iodine at High Pressure. Institute of Physics, Academia Sinica, Beijing. doi.org/10.1088/0256-307X/11/2/010
- Stefan Schneider & Karl Christe. (26 de agosto de 2019). Iodine. Encyclopædia Britannica. Recuperado de: britannica.com
- Dr. Doug Stewart. (2019). Iodine Element Facts. Chemicool. Recuperado de: chemicool.com
- National Center for Biotechnology Information. (2019). Iodine. PubChem Database. CID=807. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Rohner, F., Zimmermann, M., Jooste, P., Pandav, C., Caldwell, K., Raghavan, R., & Raiten, D. J. (2014). Biomarkers of nutrition for development–iodine review. The Journal of nutrition, 144(8), 1322S–1342S. doi:10.3945/jn.113.181974
- Advameg. (2019). Iodine. Chemistry Explained. Recuperado de: chemistryexplained.com
- Traci Pedersen. (19 de abril de 2017). Facts About Iodine. Recuperado de: livescience.com
- Megan Ware, RDN, LD. (30 de mayo de 2017). Everything you need to know about iodine. Recuperado de: medicalnewstoday.com
- National Institute of Health. (09 de julio de 2019). Iodine. Recuperado de: ods.od.nih.gov
