Trióxido de arsénico (As2O3): estructura, propiedades y usos
El trióxido de arsénico es un compuesto inorgánico cuya fórmula química es As2O3. El arsénico en su estado metálico se transforma rápidamente en este óxido, el cual es un veneno muy tóxico que puede tener manifestaciones agudas y crónicas.
Al ser el arsénico y el oxígeno elementos del bloque p, con una diferencia de electronegatividad relativamente baja, se espera que el As2O3 sea compuesto de naturaleza covalente; es decir, que predominen en su sólido los enlaces As-O, sobre las interacciones electrostáticas entre los iones As3+ y O2-.

La intoxicación aguda con trióxido de arsénico se produce por ingesta o inhalación, siendo las manifestaciones más importantes de esta: fuertes desórdenes gastrointestinales, calambres, colapso circulatorio, y edema pulmonar.
Sin embargo, a pesar de su toxicidad, ha sido utilizado industrialmente; por ejemplo, en la conservación de la madera, en la elaboración de pigmentos, semiconductores, etc. Asimismo, antiguamente se empleaba en el tratamiento de numerosas enfermedades.
El trióxido de arsénico es un compuesto anfotérico, soluble en ácidos y álcalis diluidos, insoluble en solventes orgánicos, y relativamente soluble en el agua. Se presenta como un sólido (imagen superior), con dos formas cristalinas: cúbica y monoclínica.
Índice del artículo
- 1 Estructura del trióxido de arsénico
- 2 Propiedades
- 2.1 Nombres comerciales
- 2.2 Peso molecular
- 2.3 Aspecto físico
- 2.4 Olor
- 2.5 Sabor
- 2.6 Punto de ebullición
- 2.7 Punto de fusión
- 2.8 Punto de ignición
- 2.9 Solubilidad en agua
- 2.10 Solubilidad
- 2.11 Densidad
- 2.12 Presión de vapor
- 2.13 Descomposición
- 2.14 Corrosividad
- 2.15 Calor de vaporización
- 2.16 Constante de disociación (Ka)
- 2.17 Índice de refracción
- 3 Reactividad
- 4 Nomenclatura
- 5 Usos
- 6 Referencias
A temperatura ambiente, el As2O3 cristaliza en dos polimorfos monoclínicos, ambos encontrados en el mineral claudetita. En ellos se tienen unidades pirámide trigonal AsO3, las cuales se unen por sus átomos de oxígeno para compensar la deficiencia electrónica de la unidad por sí sola.
En un polimorfo las unidades AsO3 se enlazan formando hileras (claudetita I), y en el otro se enlazan como si tejieran una red (claudetita II):
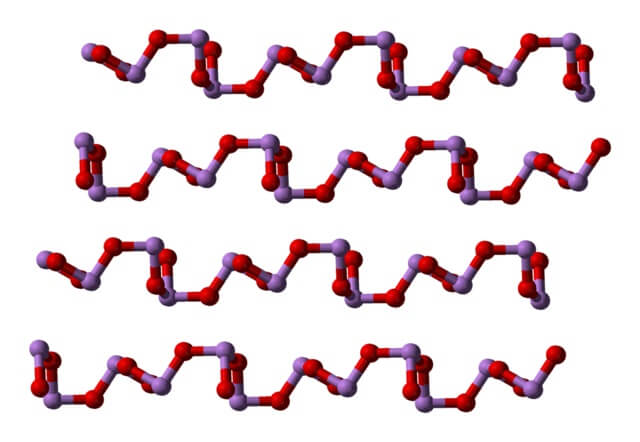
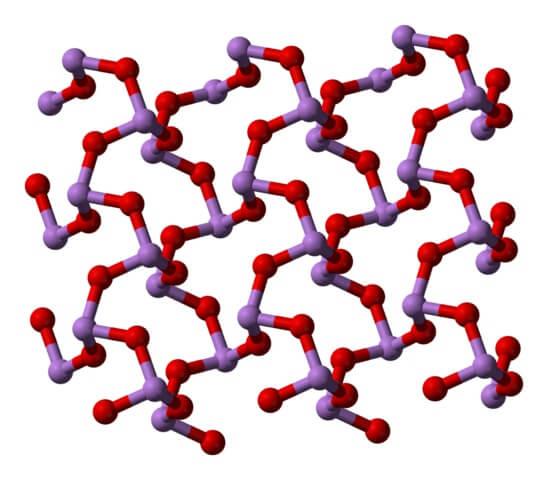
Cuando se calientan todas esas estructuras que definen cristales monoclínicos, las vibraciones son tal que se rompen varios enlaces As-O, y termina por prevalecer una molécula más pequeña: As4O6. En la imagen inferior se muestra su estructura.
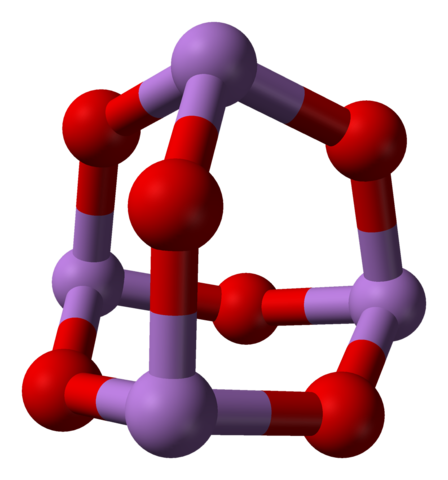
Podría decirse que consiste de un dímero de As2O3. Su estabilidad es tal que soporta 800°C en fase gaseosa; pero, por encima de esta temperatura se fragmenta en moléculas de As2O3.
El mismo As4O6 puede interaccionar entre sí para cristalizar en un sólido cúbico, cuya estructura se halla en el mineral arsenolita.
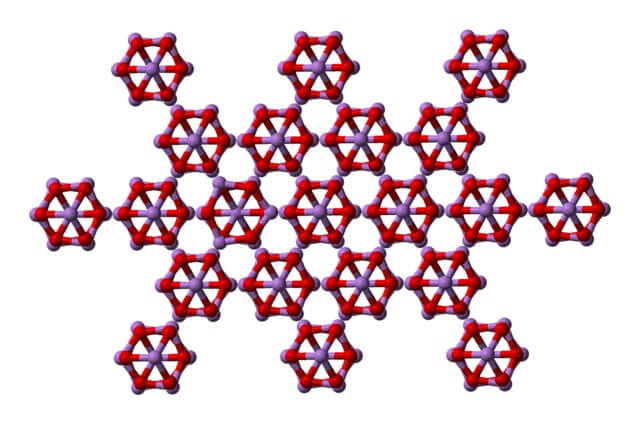
Nótese que en la imagen se está mostrando la estructura desde un plano superior. Comparándose con la claudetita, es evidente su diferencia estructural con la arsenolita. Aquí, son moléculas discretas de As4O6 que se mantienen unidades por fuerzas de Van der Waals.
-Arsenolita
-Arsodent
-Trisenox
-Claudetita
197,84 g/mol.
-Cristales cúbicos blancos (arsenolita).
-Cristales incoloros monoclínicos (Claudetita).
-Sólido blanco o transparente, vítreo, terrones amorfos o polvo cristalino.
Inodoro.
Insípido.
460 ºC.
-313 ºC (Claudetita).
-274 ºC (Arsenolita).
485 º C (sublima).
17 g/L a 18 ºC (20 g/L a 25 ºC).
Soluble en ácidos (especialmente en ácido clorhídrico) y en álcalis. Prácticamente insoluble en cloroformo y éter.
-3,85 g/cm3 (cristales cúbicos);
-4,15 g/cm3 (cristales rómbicos).
2,47·10-4 mmHg a 25 ºC.
No es combustible, pero por calentamiento puede originar un humo tóxico que puede incluir arsina.
En presencia de humedad puede ser corrosivo para los metales.
77 kJ/mol.
1,1·10-4 a 25 ºC.
-1,755 (Arsenolita)
-1,92-2,01 (Claudetita).
-El trióxido de arsénico es un compuesto anfotérico, pero funciona preferentemente como ácido.
-Puede reaccionar con el ácido clorhídrico o con el ácido fluorhídrico, formando tricloruro arsénico o trifloururo arsénico.
-Asimismo, reacciona con oxidantes de fuertes, como el ácido nítrico, originando ácido arsénico y óxido nitroso.
-El trióxido arsénico puede reaccionar con el ácido nítrico, produciendo arsina o el elemento arsénico, dependiendo de las condiciones de la reacción.
As2O3 + 6 Zn + 12 HNO3 => 2 AsH3 + 6 Zn(NO3)2 + 3 H2O.
Esta reacción sirvió de base para la creación del Test Marsh, usado para la detección del envenenamiento con arsénico.
Al As2O3 se le puede nombrar de acuerdo a las siguientes nomenclaturas, sabiendo que el arsénico trabaja con valencia +3:
-Óxido arsenioso (nomenclatura tradicional).
-Óxido de arsénico (III) (nomenclatura stock).
-Trióxido de diarsénico (nomenclatura sistemática).
-Se utiliza en la fabricación de vidrios, específicamente como agente descolorante. También se emplea en la elaboración de cerámica, productos electrónicos, y fuegos artificiales.
-Se agrega como un componte menor a las aleaciones basadas en el cobre, para aumentar la resistencia a la corrosión de los metales de la aleación.
-El As2O3 es el material de partida para la preparación de arsénico elemental, para mejorar las uniones eléctricas, y para la elaboración de semiconductores de arsenuros
-El As2O3, así como el arseniato de cobre, se usan como conservantes de la madera. Se usó en combinación con el acetato de cobre para la elaboración del pigmento verde de Paris, usado en la elaboración de pinturas y raticidas.
-El trióxido de arsénico es un compuesto que ha sido utilizado desde hace siglos en el tratamiento de numerosas enfermedades. Se usó como tónico en el tratamiento de los trastornos nutricionales, neuralgias, reumatismo, artritis, asma, corea, malaria, sífilis y tuberculosis.
-Asimismo, se ha utilizado en el tratamiento local de enfermedades de la piel, empleándose para destruir algunos epiteliomas superficiales.
-La solución de Fowler se usaba en el tratamiento de enfermedades de piel y de la leucemia. El uso de este medicamento está descontinuado.
-En la década de 1970, el investigador chino Zhang Tingdong desarrolló una investigación acerca del uso del trióxido de arsénico en el tratamiento de la leucemia promielocítica aguda (APL). Lo que condujo a la producción del medicamento Trisenox, que fue aprobado por la FDA de Estados Unidos.
-Se ha usado el Trisenox en los pacientes APL que no responden al tratamiento de “primera línea”, constituido por ácido retinoico todo trans (ATRA). Se ha evidenciado que el trióxido de arsénico induce a las células cancerosas a sufrir apoptosis.
-El Trisenox se usa como citostático en el tratamiento del subtipo promielocítico refractario (M3) de APL.
- Shen y col. (2001). Studies on the clinical efficacy and pharmacokinetics of low-dose arsenic trioxide in the treatment of relapsed acute promyelocytic leukemia: a comparison with conventional dosage. Leukemia 15, 735–741.
- Science Direct. (2014). Arsenic Trioxide. El Sevier. Recuperado de: sciencedirect.com
- Wikipedia. (2019). Arsenic trioxide. Recuperado de: en.wikipedia.org
- PubChem. (2019). Arsenic (III) oxide. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Deborah M. Rusta and Steven L. Soignetb. (2001). Risk/Benefit Profile of Arsenic Trioxide. The Oncologist vol. 6 Supplement 2 29-32.
- The New England Journal of Medicine. (11 de julio de 2013). Retinoic Acid and Arsenic Trioxide for Acute Promyelocytic Leukemia. n engl j med 369;2.
