Cadmio (Cd): historia, propiedades, estructura, usos
El cadmio (Cd) es un metal de transición o postransicional de número atómico 48 y de color plateado. Es maleable y dúctil, con puntos de fusión y ebullición relativamente bajos. El cadmio es un elemento raro y apenas tiene una concentración de 0,2 g / tonelada de corteza terrestre.
La greenockita (CdS) es la única mena importante del cadmio que presenta una coloración amarilla intensa. El cadmio se encuentra asociado con el cinc en la esfalerita (ZnS), la cual contiene entre 0,1 y 03 % de cadmio como catión Cd2+.

Al procesar la esfalerita para la obtención, fundición y refinación del cinc, se obtiene en forma secundaria el cadmio, siendo esta su principal fuente de producción.
Este metal fue descubierto en 1817, en forma independiente por Friedrich Stromayer y Karl Hermann. Stromayer bautizó el nuevo elemento con el nombre de cadmium, originado de la palabra latina “cadmia”, término como se conocía a la calamina (carbonato de zinc).

El cadmio es un elemento de gran utilidad y numerosas aplicaciones, tales como anticorrosivo del hierro, acero y metales no ferrosos; uso como pigmento; estabilización del PVC; elemento en aleaciones usadas en soldaduras; baterías de níquel-cadmio recargables, etc.
No obstante, es un elemento muy tóxico que provoca daños severos en los pulmones, riñones y en los huesos, e inclusive se le ha señalado una acción carcinogénica, razón por la cual se ha limitado su uso. Pero a pesar de ello, se ha continuado empleando cuidadosamente en algunas aplicaciones.
Índice del artículo
- 1 Historia
- 2 Propiedades físicas y químicas del cadmio
- 2.1 Apariencia
- 2.2 Peso atómico estándar
- 2.3 Número atómico (Z)
- 2.4 Categoría del elemento
- 2.5 Olor
- 2.6 Punto de fusión
- 2.7 Punto de ebullición
- 2.8 Densidad
- 2.9 Calor de fusión
- 2.10 Calor de vaporización
- 2.11 Capacidad calórica molar
- 2.12 Electronegatividad
- 2.13 Energías de ionización
- 2.14 Conductividad térmica
- 2.15 Resistividad eléctrica
- 2.16 Dureza
- 2.17 Estabilidad
- 2.18 Auto-ignición
- 2.19 Índice de refracción
- 2.20 Reactividad
- 3 Estructura y configuración electrónica
- 4 Dónde se encuentra y obtención
- 5 Isótopos
- 6 Riesgos
- 7 Usos
- 8 Referencias
El cadmio fue descubierto por Friedrich Stromayer, un químico alemán, en el año de 1817 en una muestra de carbonato de zinc (calamina). Ese mismo año, K. S. L. Hermann y J. C. H. Roloff hicieron el mismo descubrimiento, en forma independiente, en un experimento realizado con sulfuro de zinc.
Se ha señalado que Stromayer hizo su descubrimiento durante el cumplimiento de una solicitud del gobierno para inspeccionar las farmacias de la ciudad de Hildesheim, Alemania. El óxido de zinc, al igual que ahora, se usaba en el tratamiento de ciertas afecciones de la piel.
Parece ser que las farmacias no expedían el óxido de zinc, sino en su lugar vendían el carbonato de zinc: materia prima para la producción de óxido de zinc. Los fabricantes del óxido de zinc argumentaban que al calentar el carbonato de zinc se producía un “óxido de zinc” de color amarillo.
Óxido de cadmio
No podían vender este “óxido de zinc”, ya que el color del compuesto normalmente era blanco; y en su lugar, vendían el carbonato de zinc, también de color blanco. Ante esta situación, Stromayer decidió estudiar el supuesto óxido de zinc amarillo.
Para ello, calentó muestras del carbonato de zinc (calamina) y se produjo un óxido de zinc amarillo, tal como se le había informado. Después de analizarlo, concluyó que el color amarillo era producto por la presencia de un óxido metálico de un nuevo elemento.
Después de extraer este nuevo óxido metálico, produjo su reducción, logrando el aislamiento del cadmio. Stromayer le determinó su densidad y obtuvo un valor de 8,75 g/cm3, cercano al valor conocido actualmente para este parámetro (8,65 g/cm3).
Asimismo, Stromayer señaló que el nuevo elemento tenía una apariencia semejante al platino, y que además estaba presente en muchos compuestos de zinc, e inclusive, en el zinc purificado.
Stromayer sugirió el nombre de “cadmium” proveniente de la voz latina “cadmia”, nombre con que se denominaba a la calamina, ZnCO3.
Cadmio en el sulfuro de zinc
Karl Hermann (1817) encontró un color amarillo no esperado cuando procesaba el sulfuro de zinc y pensó que podía ser una contaminación con arsénico. Pero una vez descartada esta posibilidad, Hermann se dio cuenta que estaba en presencia de un nuevo elemento.
1840-1940
En la década de 1840 comenzó a explotarse comercialmente el uso del cadmio como pigmento. El Codex Farmacéutico Británico señala en 1907 el uso del yoduro de cadmio como medicamento para tratar “articulaciones agrandadas”, glándulas escrofulosas y sabañones.
En las décadas de 1930 y 1940, la producción de cadmio estaba destinada al platinado del acero y del hierro para protegerlos de la corrosión. En la década de 1950, se usó compuestos del cadmio, como el sulfuro de cadmio y el selenuro de cadmio como fuentes de pigmentos rojos, anaranjados y amarillos.
1970-1990
En las décadas de 1970 y 1980 se descubrió que los compuestos laurato de cadmio y estearato de cadmio eran estabilizadores del PVC, lo que produjo un incremento en la demanda de cadmio. Sin embargo, las regulaciones ambientales por la toxicidad del cadmio, provocó una disminución en su consumo.
En las décadas de 1980 y 1990 dejó de usarse el cadmio en muchas de sus aplicaciones, pero luego aumentó su producción con la creación de las baterías recargables de níquel-cadmio, las cuales llegaron a representar el 80 % del consumo de cadmio en Estados Unidos.
Blanco grisáceo plateado con lustre metálico y blando. Se torna quebradizo por la exposición a 80 ºC, pudiéndose cortar con un cuchillo. Es maleable y se pueden formar rollos con él.
112,414 u
48
Metal postransicional, alternativamente considerado un metal de transición. La definición de la IUPAC de un metal de transición es aquel cuyos átomos tienen una subcapa d incompleta o que pueden dar lugar a cationes con una subcapa d incompleta.
De acuerdo a esa definición, el cadmio no es un metal de transición ya que su catión Cd2+ tiene sus orbitales 4d completamente llenos de electrones (4d10).
Inodoro
321,07 ºC
767 ºC
Temperatura ambiente: 8,65 g/cm3
En el punto de fusión (líquido): 7,996 g/cm3
6,21 kJ/mol
99,87 kJ/mol
26,020 J/(mol·K)
1,6 en la escala de Pauling
Primera: 867,8 kJ/mol (Cd+ gaseoso)
Segunda: 1631,4 kJ/mol (Cd2+ gaseoso)
Tercera: 3616 kJ/mol (Cd3+ gaseoso)
96,6 W/(m·K)
72,7 nΩ·m a 22 ºC
2,0 en la escala Mohs. Es un metal, aunque denso, considerablemente blando.
Es lentamente oxidado por el aire húmedo para formar óxido de cadmio, lo cual empaña su brillo metálico. No es inflamable, pero en forma de polvo puede arder y experimentar auto ignición.
250 ºC para el cadmio es forma de polvo.
1,8 a 20 ºC
El cadmio puede arder en el aire para formar el óxido de cadmio (CaO), un polvo amorfo de color marrón, mientras la forma cristalina es de color rojo oscuro.
El cadmio reacciona rápidamente con el ácido nítrico diluido, y lentamente con el ácido clorhídrico en caliente. También es capaz de reaccionar con el ácido sulfúrico, pero no reacciona con los álcalis. En todas estas reacciones se forma sales de cadmio de sus correspondientes aniones (Cl–) u oxoaniones (NO3– y SO42-).
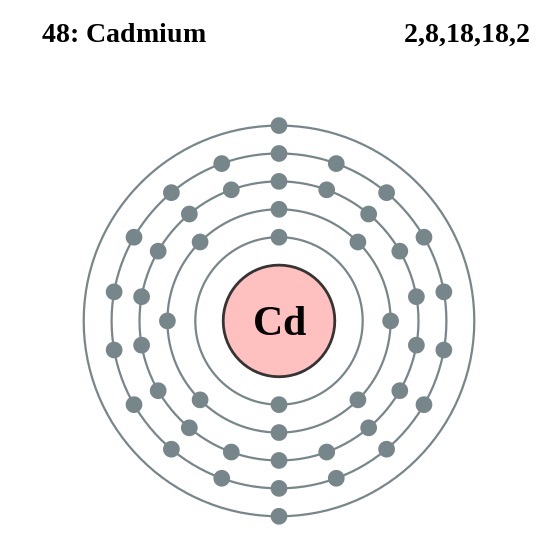
Los átomos de cadmio de su cristal establecen un enlace metálico a partir de sus electrones de valencia, los cuales se ubican en los orbitales 4d y 5s de acuerdo a su configuración electrónica:
[Kr] 4d10 5s2
No obstante, aunque los orbitales 4d estén llenos de electrones, y que pueda pensarse además que el “mar de electrones” sea abundante como para cohesionar fuertemente los átomos Cd, en realidad las interacciones son débiles. Esto puede demostrarse experimentalmente con su bajo punto de fusión (321 ºC), comparado al de otros metales de transición.
Por esto, y otras razones químicas, el cadmio a veces no se le considera un metal de transición. Hay tantos electrones (doce) involucrados en su enlace metálico, que comienzan a perturbar en sumo grado sus repulsiones negativas; lo cual, junto con la diferencia energética entre los orbitales 4d llenos y los 5s, debilitan la interacción Cd—Cd.
Los átomos Cd terminan definiendo una estructura cristalina hexagonal compacta (hcp), la cual no sufre transiciones de fase antes de su punto de fusión. Cuando los cristales hcp de cadmio se someten a una presión equivalente a 10 GPa, la estructura solamente se deforma; pero sin que se reporte cambio de fase alguno.
El cadmio no puede perder los doce electrones de valencia; de hecho, no puede perder siquiera uno de sus orbitales 4d, más estables en energía en comparación al orbital 5s. Por lo tanto solo puede perder los dos electrones del orbital 5s2, siendo en consecuencia un metal divalente; tal como sucede con el zinc, mercurio y los metales alcalinotérreos (Sr. Becambara).
Cuando en sus compuestos se asume la existencia del catión Cd2+, se dice entonces que el cadmio tiene un número o estado de oxidación de +2. Este es su principal número de oxidación. Por ejemplo, los siguientes compuestos contienen al cadmio como +2: CdO (Cd2+O2-), CdCl2 (Cd2+Cl2–), CdSO4 (Cd2+SO42-) y Cd(NO3)2.
Además de este número de oxidación, también están el +1 (Cd+) y el -2 (Cd2-). El número de oxidación +1 se observa en el dicatión Cd22+, en el que cada átomo de cadmio posee una carga positiva. Mientras, el -2 es bastante extraño, y aplicaría para el anión “cadmuro”.

El cadmio es un elemento raro que tiene una concentración de 0,2 g / tonelada de la corteza terrestre. El único mineral importante del cadmio es la greenockita (CdS), la cual no es explotable desde el punto de vista minero y comercial.
El cadmio se encuentra asociado al zinc en el mineral esfalerita (ZnS), el cual suele contenerlo a una concentración que oscila entre el 0,1 % y el 0,3 %; pero en algunos casos la concentración de cadmio en la esfalerita puede alcanzar el 1,4 %.
Las rocas procesadas para la obtención de fertilizantes de fósforo pueden tener una concentración de cadmio de 300 mg / kg de fertilizante. También el carbón puede contener cantidades pequeñas, pero significativas de cadmio.
Una fuente importante de cadmio son las emisiones volcánicas que puede llevar el cadmio a las aguas superficiales. El uso de fertilizantes fosforados en los suelos de uso agrícola ha conllevado su contaminación con cadmio.
El cadmio presente en los suelos ácidos es absorbible por los vegetales. Algunos de los vegetales son utilizados por el hombre como alimentos, lo que explica cómo la ingesta de agua y alimentos es la fuente principal de ingreso de cadmio en las personas no expuestas profesionalmente o fumadoras.
Durante la explotación minera, fundición y refinación del zinc presente en la esfalerita, se suele obtener el cadmio como un producto secundario. También ocurre un hecho semejante, aunque en mucho menor grado, durante el procesamiento del cobre y el plomo.
Igualmente, pueden obtenerse pequeñas cantidades de cadmio producto del reciclaje del hierro y de los desechos de acero.
La esfalerita se somete a tostación para que el sulfuro de cinc se transforme en su óxido, ZnO. La misma reacción la sufre el sulfuro de cadmio:
2 ZnS + 3 O2 → 2 ZnO + 2 SO2
Si esta mezcla de óxido se calienta con carbón, se reducirán a sus respectivos metales:
ZnO + CO → Zn + CO2
Asimismo, el cinc y cadmio pueden producirse mediante la electrólisis al disolverse los óxidos en ácido sulfúrico.
Cualquiera de los dos métodos genera un cinc contaminado con cadmio. Al fundirse, el cadmio puede destilarse al vacío debido a su menor punto de fusión (321 °C) en comparación al de cinc (420 °C).
Entre los isótopos naturales y estables del cadmio tenemos, con sus respectivas abundancias aquí en la Tierra:
–106Cd (1,25%)
–108Cd (0.89%)
–110Cd (12,47%)
–111Cd (12,8%)
–112Cd (24,11%)
–114Cd (28,75%)
–113Cd (12,23%)
El 113Cd es radiactivo, pero debido al valor tan grande de su vida media (t1/2= 7,7·1015 años), puede considerarse estable. Y luego está el 116Cd, también radiactivo, con una vida media de 3,1·1019 años, por lo que puede considerarse un isótopo estable, representando el 7,51 % del cadmio.
Nótese que la masa atómica promedia es de 112,414 u, más cercana 112 que de 114. No se observa en el cadmio la existencia de un isótopo predominante por encima de los otros.
La absorción de cadmio ocurre principalmente por los alimentos, especialmente el hígado, los champiñones, mariscos, cacao en polvo y algas secas.
Un caso emblemático ocurrió en China en el siglo pasado, donde hubo una contaminación importante con cadmio en la población. La contaminación de cadmio fue debida a su alta concentración en el arroz, causado por la presencia de cadmio en los suelos de cultivo del cereal.
Un fumador tiene en promedio una ingesta de 60 µg / día. La máxima concentración del cadmio permitida en la sangre es de 15 µg / día. Los no fumadores tienen una concentración de cadmio en la sangre alrededor de 0,5 µg / L.
Los pulmones absorben entre el 40 y el 60 % del cadmio presente en el humo del tabaco. El cadmio absorbido en los pulmones es transportado en la sangre, formando complejos con proteínas, cisteína y glutationa, los cuales terminan luego en el hígado, los riñones, etc.
Una inhalación aguda de cadmio puede producir síntomas semejantes a los observados en un proceso gripal; tales como resfrío, fiebre y dolores musculares, pudiendo causar un daño pulmonar. Mientras, la exposición crónica al cadmio puede causar enfermedad de los pulmones, los riñones y los huesos.
En los riñones, el cadmio suele provocar una alteración en el metabolismo del fósforo y el calcio, puesta en evidencia por un incremento en la producción de cálculos renales. Además, provoca daño renal manifestado en la aparición en la orina de la proteína transportadora de retinol y la β-2-microglobulina.
La exposición materna al cadmio está asociada con un bajo peso del niño al nacer y un incremento en la tasa de abortos espontáneos.
El cadmio está relacionado en Japón con la presencia de la enfermedad de Itai-Itai en el siglo pasado. Esta enfermedad se caracteriza por una baja mineralización del hueso, fragilidad ósea con alta tasa de fracturas, incremento de la osteoporosis y dolor óseo.
Aunque experimentos realizados en ratas establecieron una relación entre el cadmio y el cáncer prostático, esta no ha sido demostrada en humanos. Se ha puesto en evidencia una asociación entre el cadmio y el cáncer renal, y también se le ha vinculado con el cáncer pulmonar.

El hidróxido de cadmio se utilizó como cátodo en las baterías Ni-Cd. Estas se usaron en la industria ferroviaria y aeronáutica, así como en instrumentos de uso colectivo que incluyen teléfonos celulares, videocámaras, computadoras portátiles, etc.
El consumo de cadmio para la elaboración de las baterías Ni-Cd representó el 80 % de la producción de cadmio. Sin embargo, debido a la toxicidad de este elemento, las baterías Ni-Cd han sido reemplazadas gradualmente por las baterías de hidruro de níquel-metal.

El sulfuro de cadmio se usa como pigmento amarillo y el seleniuro de cadmio como pigmento rojo, conocido con el nombre de rojo cadmio. Estos pigmentos se caracterizan por su brillantez e intensidad, por lo que han sido utilizados en plásticos, cerámicas, vidrios, esmaltes y colores artísticos.
Se ha señalado que el pintor Vincent Van Gogh usaba en sus pinturas pigmentos de cadmio, los cuales le permitían la consecución de una variedad de rojos, anaranjados y amarillos brillantes.
La coloración de los pigmentos de cadmio debe ser atenuada antes de ser molidos con aceites o mezclados en acuarelas y acrílicos.
Componentes que contienen cadmio se utilizaron en el fósforo de los televisores en blanco y negro, así como en los fósforos azul y verde para los tubos de imagen de la televisión a color.
El fósforo formaba parte de la pantalla que era irradiada por los rayos catódicos, siendo responsable de formación de la imagen. El cadmio, a pesar de su toxicidad, ha comenzado a utilizarse en los televisores QLED de creación reciente.
Compuestos de cadmio formados con el carboxilato, el laurato y el estereato fueron usados como estabilizantes del cloruro de polivinilo, ya que retrasan la degradación producida por la exposición al calor y a la luz ultravioleta que descomponen el PVC durante su proceso de fabricación.
Debido a la toxicidad del cadmio, otra vez, han sido reemplazados los estabilizantes de PVC unidos al cadmio por otros estabilizantes, como el bario-zinc, el calcio-zinc y el organoestaño.
El cadmio ha sido utilizado en aleaciones para rodamientos debido a su alta resistencia a la fatiga y bajo coeficiente de fricción. El cadmio tiene un punto de fusión relativamente bajo, por lo que se usa en aleaciones de bajo punto de fusión, y es componente además de muchos tipos de soldaduras.
También el cadmio puede utilizarse en aleaciones de conductividad eléctrica, de conductividad térmicas y de contacto eléctrico.
El cadmio se utiliza para la protección del acero, el aluminio y otros elementos de fijación de metales no ferrosos, así como de piezas móviles. El recubrimiento de cadmio suministra protección a la corrosión en aquellos medios salinos y alcalinos. Además, sirve como lubricante.
También se emplea el cadmio en muchas aplicaciones eléctricas y electrónicas que necesitan de resistencia a la corrosión y baja resistividad eléctrica.
El cadmio se usa en los reactores nucleares por su capacidad de captar los neutrones, lo que permite controlar el exceso de neutrones producto de la fisión nuclear, evitando fisiones nucleares adicionales.
El seleniuro y teluriuro de cadmio son compuestos que cumplen la función de semiconductores en la detección de la luz y en las celdas solares. El HgCdTe es sensible a la luz infrarroja y se usa como detector de movimiento, así como en un interruptor para los dispositivos de control remoto.

El helio-Cd intervienen en la formación de un rayo láser de luz azul-violeta de una longitud onda que oscila entre 325 y 422 nm, utilizable en los microscopios de fluorescencia.
El cadmio se usa en biología molecular para bloquear los canales de calcio, dependientes del potencial de membrana.
- Wikipedia. (2019). Cadmium. Recuperado de: en.wikipedia.org
- Selva V. R. & et al. (2014). High pressure and temperature structure of liquid and solid Cd: Implications for the melting curve of Cd. Recuperado de: researchgate.net
- Dr. Dough Stewart. (2019). Cadmium Element Facts. Recuperado de: chemicool.com
- National Center for Biotechnology Information. (2019). Cadmium. PubChem Database. CID=23973. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Godt, J., Scheidig, F., Grosse-Siestrup, C., Esche, V., Brandenburg, P., Reich, A., & Groneberg, D. A. (2006). The toxicity of cadmium and resulting hazards for human health. Journal of occupational medicine and toxicology (London, England), 1, 22. doi:10.1186/1745-6673-1-22
- Ros Rachel. (30 de julio de 2018). Facts about camium. Recuperado de: livescience.com
- The Editors of Encyclopaedia Britannica. (06 de septiembre de 2018). Cadmium. Encyclopædia Britannica. Recuperado de: britannica.com
- International Cadmium Association. (s.f.). Cadmium applications. Recuperado de: cadmium.org
- Lenntech B. V. (2019). Cadmium. Recuperado de: lenntech.com
