Fenilalanina: características, funciones, biosíntesis, alimentos
La fenilalanina (Phe, F) es uno de los 9 aminoácidos esenciales, es decir, no es sintetizado endógenamente por el cuerpo humano. En su cadena lateral, este aminoácido posee un compuesto aromático no polar que lo caracteriza.
La fenilalanina, o ácido β-fenil-α-amino propiónico, fue identificada por primera vez en 1879 por los científicos J. H. Schulze y M. Barbieri a partir de una planta de la familia Fabaceae conocida como Lupinus luteus o “altramuz amarillo”.
El dipéptido L-fenilalanina-L-aspartil es conocido como aspartame o “NutraSweet”, que es un edulcorante producido de forma sintética y ampliamente utilizado en los restaurantes y cafeterías, típicamente para endulzar bebidas como el café, el té, la limonada y otras bebidas.
En las frutas con características climatéricas, la conversión de L-fenilalanina en ésteres fenólicos como el eugenol y sus derivados metílicos es la que da lugar al olor dulce floral o similar a la miel típico de los frutos de bananos y plátanos cuando se encuentran maduros.
Dependiendo de la forma, la fenilalanina puede tener sabores diferentes. Por ejemplo, la forma L-fenilalanina tiene un aroma y un sabor dulces, mientras que la D-fenilalanina es ligeramente amarga y es usualmente inodora.
Puesto que tiene un fuerte carácter hidrofóbico, la fenilalanina es uno de los principales constituyentes de muchas de las resinas en la naturaleza como, por ejemplo, el poliestireno. Estas resinas, al entrar en contacto con moléculas de agua, forman una estructura protectora o de cobertura conocida como “clatrato”.
Los genes que codifican para la ruta de biosíntesis de la fenilalanina son utilizados por los botánicos como relojes evolutivos, ya que se ha encontrado que estos están relacionados con la diversificación morfológica de las plantas terrestres.
Índice del artículo
- 1 Características y estructura
- 2 Funciones
- 3 Biosíntesis
- 4 Degradación
- 5 Alimentos ricos en fenilalanina
- 6 Beneficios de su ingesta
- 7 Trastornos por deficiencia
- 8 Referencias
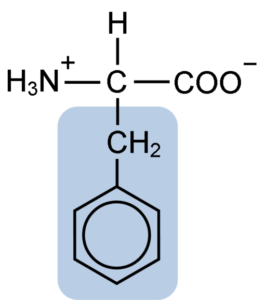
La fenilalanina comparte con todos los aminoácidos el grupo carboxilo (-COOH), el grupo amino (-NH2), y el átomo de hidrógeno (-H) que están unidos a un átomo de carbono central conocido como carbono α. Además, por supuesto, posee una cadena lateral o grupo R característico.
La fenilalanina es uno de los tres aminoácidos que poseen anillos aromáticos o bencénicos como sustituyentes en las cadenas laterales. Estos compuestos no son polares y, por tanto, son altamente hidrofóbicos.
El aminoácido en cuestión es especialmente hidrofóbico, pues, a diferencia de la tirosina y el triptófano (los otros dos aminoácidos con anillos aromáticos) no posee grupos amino o hidroxilo unidos a su anillo bencénico.
El grupo aromático, benzoico o areno de la fenilalanina tiene la estructura típica del benceno: el anillo cíclico está estructurado por 6 átomos de carbono que tienen resonancia entre ellos debido a la presencia de tres dobles enlaces y de tres enlaces simples en su interior.
A diferencia de la tirosina y el triptófano, que a pH básicos pueden adquirir carga positiva y negativa, respectivamente, la fenilalanina conserva su carga neutra, pues el anillo bencénico no se ioniza y las cargas de los grupos carboxilo y amino se neutralizan entre sí.
Los aminoácidos son clasificados en diferentes grupos según las características que poseen sus cadenas laterales o grupos R, dado que estos pueden variar en tamaño, estructura, grupos funcionales e incluso en carga eléctrica.
Como se ha comentado, la fenilalanina se clasifica dentro del grupo de los aminoácidos aromáticos, junto con la tirosina y el triptófano. Todos estos compuestos presentan anillos aromáticos en su estructura, no obstante, la tirosina y el triptófano poseen grupos ionizables en los sustituyentes de sus grupos R.
Las características de absorción de luz de las proteínas a una longitud de onda de 280 nm se debe a la presencia de los aminoácidos clasificados dentro del grupo de la fenilalanina, ya que estos absorben fácilmente la luz ultravioleta a través de sus anillos aromáticos.
Empero, se ha demostrado que la fenilalanina absorbe en mucha menor proporción que la tirosina y el triptófano, por lo que en el análisis de algunas proteínas su absorbancia es predecible.
Todos los aminoácidos poseen un carbono central de tipo quiral, que tiene cuatro átomos o grupos diferentes unidos y, como ya se ha dicho, este átomo es identificado como el carbono α. En base a este carbono se pueden encontrar al menos dos estereoisómeros de cada aminoácido.
Los estereoisómeros son moléculas con imágenes especulares, que tienen la misma fórmula molecular, pero que no son superponibles entre sí como, por ejemplo, las manos y los pies. Los compuestos que de forma experimental rotan el plano de luz polarizada a la derecha se denotan con la letra D, y los que lo hacen hacia la izquierda, con la letra L.
Es importante comentar que la distinción entre las formas D-fenilalanina y L-fenilalanina es clave para entender el metabolismo de este aminoácido en el cuerpo de los vertebrados.
La forma L-fenilalanina es metabolizada y aprovechada para la construcción de las proteínas celulares, mientras que la D-fenilalanina se ha encontrado en el torrente sanguíneo como un agente protector contra las especies reactivas de oxígeno (ROS).
En los años 90 se pensaba que la fenilalanina solo se encontraba en algunas especies de plantas. Sin embargo, hoy en día se sabe que está presente en casi todos los dominios hidrofóbicos de las proteínas, de hecho, la fenilalanina es el principal componente de las especies químicas aromáticas de las proteínas.
En las plantas, la fenilalanina es un componente esencial de todas las proteínas; además, es uno de los precursores de los metabolitos secundarios como los fenilpropanoides (que forman parte de los pigmentos) de las moléculas defensivas, de los flavonoides, de biopolímeros como la lignina y la suberina, entre otros.
La fenilalanina es la estructura básica para formar muchas de las moléculas que mantienen la homeostasis neuronal, entre las que se encuentran péptidos como la vasopresina, la melanotropina y la encefalina. Además, este aminoácido está implicado directamente en la síntesis de la hormona adrenocorticotrópica (ACTH).
Al igual que gran parte de los aminoácidos proteicos, la fenilalanina forma parte del grupo de los aminoácidos cetogénicos y glucogénicos, ya que provee el esqueleto carbonado de intermediarios del ciclo de Krebs, necesario para el metabolismo energético celular y corporal.
Cuando se encuentra en exceso, la fenilalanina es transformada en tirosina y posteriormente en fumarato, un intermediario del ciclo de Krebs.
La fenilalanina es uno de los pocos aminoácidos que no puede ser sintetizado por la mayoría de los organismos vertebrados. En la actualidad solo se conocen rutas biosintéticas para este aminoácido en organismos procariotas, en levaduras, en las plantas y en algunas especies de hongos.
Los genes responsables de la ruta de síntesis se encuentran muy conservados entre plantas y microorganismos, por tanto, la biosíntesis tiene pasos semejantes en casi todas las especies. Incluso algunas enzimas de la ruta están presentes en algunos animales, sin embargo, estos no son capaces de sintetizarla.
En las especies vegetales, la fenilalanina es sintetizada a través de una ruta metabólica interna en los cloroplastos que se conoce como “ruta del prefenato”. Dicha ruta está relacionada metabólicamente con “la ruta del shikimato”, a través del L-arogenato, uno de los metabolitos producidos durante esta última.
La enzima arogenato deshidratasa cataliza una reacción de tres pasos, en la que transforma el anillo aromático del arogenato al anillo bencénico característico de la fenilalanina.
Esta enzima cataliza una transaminación, una deshidratación y una descarboxilación para depurar el anillo aromático del arogenato y obtener un anillo sin sustituyentes.
El prefenato junto al fenilpiruvato acumulado en el interior (la luz) del cloroplasto, puede ser convertido a fenilalanina mediante la reacción catalizada por la enzima profenato aminotransferasa, que transfiere un grupo amino al fenilpiruvato para que este sea reconocido por la arogenato deshidratasa y se incorpore a la síntesis de fenilalanina.
En algunas especies de Pseudomonas se han descrito rutas alternas a la del profenato, que utilizan enzimas diferentes pero cuyos sustratos para la síntesis de la fenilalanina también son el prefenato y el arogenato.
La fenilalanina puede ser metabolizada de múltiples formas a partir de los alimentos. No obstante, la mayor cantidad de estudios se enfocan en su destino en las células del tejido nervioso central y de los tejidos renales.
El hígado es el principal órgano para la degradación o el catabolismo de la fenilalanina. En los hepatocitos existe una enzima conocida como fenilalanina hidroxilasa, capaz de transformar la fenilalanina en tirosina o en el compuesto L-3,4-dihidroxifenilalanina (L-DOPA).
El compuesto L-DOPA es precursor de la norepinefrina, de la epinefrina y de otras hormonas y péptidos con actividad en el sistema nervioso.
La fenilalanina puede ser oxidada en las células cerebrales por medio de la enzima tirosina hidroxilasa, que se encarga de catalizar la conversión de la fenilalanina en dopacromo en presencia de ácido L-ascórbico.
Anteriormente se pensaba que la enzima tirosina hidroxilasa hidroxilaba únicamente tirosina, sin embargo, se encontró que esta hidroxila fenilalanina y tirosina en la misma proporción y que la hidroxilación de la fenilalanina inhibe la hidroxilación de la tirosina.
En la actualidad se sabe que altas proporciones de tirosina inhiben la actividad enzimática de la tirosina hidroxilasa, pero lo mismo no es cierto para la fenilalanina.
Todos los alimentos ricos en proteínas poseen un contenido de fenilalanina de entre 400 y 700 mg por la porción de alimento ingerida. Los alimentos como el aceite de bacalao, el atún fresco, las langostas, las ostras y otros bivalvos, contienen más de 1.000 mg por porción de alimento ingerida.
Las carnes bovinas y porcinas también poseen altos niveles de fenilalanina. Sin embargo, no son tan altos como las concentraciones presentes en los animales marinos. Por ejemplo, el tocino, la carne de res, el hígado, el pollo y los lácteos tienen entre 700 y 900 mg de fenilalanina por ración de alimento.
Los frutos secos como el maní y las nueces de distintos tipos son otros alimentos que poseen una buena cantidad de fenilalanina. Los granos como la soya, los garbanzos y demás legumbres pueden proporcionar entre 500 y 700 mg de fenilalanina por porción.
Como fuente alterna se puede metabolizar la fenilalanina a partir del aspartame en las bebidas gaseosas, la goma de mascar, las gelatinas y algunos dulces o postres donde este dipéptido es utilizado como edulcorante.
La fenilalanina se encuentra en todos los alimentos ricos en proteínas que consumimos. El consumo diario mínimo para adultos de peso y talla promedio está alrededor de 1000 mg, necesario para la síntesis de proteínas, de hormonas como la dopamina, de distintos neurotransmisores, etc.
El consumo de este aminoácido en exceso es recetado para las personas que presentan trastornos depresivos, dolores articulares y enfermedades en la piel, ya que su consumo incrementa la síntesis de proteínas y biomoléculas transmisoras como la epinefrina, norepinefrina y la dopamina.
Algunos estudios sugieren que la fenilalanina consumida en exceso no produce mejoras significativas en ninguno de estos trastornos, pero su conversión en tirosina, que también es empleada para la síntesis de moléculas de señalización, puede explicar los efectos positivos sobre señalización celular en el sistema nervioso.
Fármacos formulados contra el estreñimiento presentan núcleos estructurados por fenilalanina, tirosina y triptófano. Generalmente estos medicamentos contienen mezclas de estos tres aminoácidos en sus formas L- y D-.
Los niveles de fenilalanina en la sangre son importantes para mantener el correcto funcionamiento del cerebro, ya que la fenilalanina, la tirosina y el triptófano son los sustratos para el ensamblaje de diferentes neurotransmisores.
Algunos trastornos se relacionan, más bien, con déficits en el metabolismo de este aminoácido, lo que genera un exceso del mismo, en vez de una deficiencia.
La fenilcetonuria, una enfermedad hereditaria poco común en las mujeres, afecta la hidroxilación hepática de la fenilalanina y hace que los niveles plasmáticos de ese aminoácido sean excesivos, por lo que se induce una apoptosis neuronal y afecta el desarrollo normal del cerebro.
Si una mujer con fenilcetonuria queda embarazada, el feto puede presentar lo que se conoce como el “síndrome fetal de hiperfenilalaninemia materna”.
Este se debe a que el feto presenta elevadas concentraciones de fenilalanina en la sangre (casi el doble de los estándares), cuyo origen está relacionado con la ausencia de la fenilalanina hidroxilasa hepática del feto, que no se desarrolla sino hasta las 26 semanas de gestación.
El síndrome fetal por hiperfenilalaninemia materna, produce microcefalia fetal, abortos recurrentes, cardiopatías e incluso malformaciones renales.
- Biondi, R., Brancorsini, S., Poli, G., Egidi, M. G., Capodicasa, E., Bottiglieri, L., … & Micu, R. (2018). Detection and scavenging of hydroxyl radical via D-phenylalanine hydroxylation in human fluids. Talanta, 181, 172-181
- Cho, M. H., Corea, O. R., Yang, H., Bedgar, D. L., Laskar, D. D., Anterola, A. M., … & Kang, C. (2007). Phenylalanine biosynthesis in Arabidopsis thaliana identification and characterization of Arogenate dehydratases. Journal of Biological Chemistry, 282(42), 30827-30835.
- Fernstrom, J. D., & Fernstrom, M. H. (2007). Tyrosine, phenylalanine, and catecholamine synthesis and function in the brain. The Journal of Nutrition, 137(6), 1539S-1547S.
- Hou, J., Vázquez-González, M., Fadeev, M., Liu, X., Lavi, R., & Willner, I. (2018). Catalyzed and Electrocatalyzed Oxidation of l-Tyrosine and l-Phenylalanine to Dopachrome by Nanozymes. Nano letters, 18(6), 4015-4022.
- Nelson, D. L., Lehninger, A. L., & Cox, M. M. (2008). Lehninger Principles of Biochemistry. Macmillan.
- Perkins, R., & Vaida, V. (2017). Phenylalanine increases membrane permeability. Journal of the American Chemical Society, 139(41), 14388-14391.
- Plimmer, R. H. A. (1912). The Chemical Constitution of the Proteins (Vol. 1). Longmans, Green.
- Tinsley, G. (2018). HealthLine. Retrieved September 5, 2018, from www.healthline.com/nutrition/phenylalanine
- Tohge, T., Watanabe, M., Hoefgen, R., & Fernie, A. R. (2013). Shikimate and phenylalanine biosynthesis in the green lineage. Frontiers in Plant Science, 4, 62.
