Cloruro de estroncio (SrCl2): estructura química, propiedades, usos
¿Qué es el cloruro de estroncio?
El cloruro de estroncio es un compuesto inorgánico formado por estroncio, metal alcalinotérreo (Sr. Becamgbara) y el halógeno cloro. Debido a que ambos elementos poseen electronegatividades muy diferentes, el compuesto es un sólido iónico cuya fórmula química es SrCl2.
Como es un sólido iónico, está constituido por iones. Para el caso del SrCl2, son un catión Sr2+ por cada dos aniones Cl–. Sus propiedades y aplicaciones son similares a los cloruros de calcio y bario, con la diferencia de que los compuestos de estroncio son relativamente más raros de conseguir y, por ende, más costosos.
Al igual que el cloruro de calcio (CaCl2), es higroscópico y sus cristales absorben agua hasta formar la sal hexahidratada, en la cual seis moléculas de agua están presentes en el enrejado cristalino (SrCl2·6H2O). De hecho, comercialmente es mayor la disponibilidad del hidrato que del SrCl2 anhidro (sin agua).
Una de sus principales aplicaciones es como precursor de otros compuestos de estroncio; es decir, constituye la fuente de estroncio en determinadas síntesis químicas.
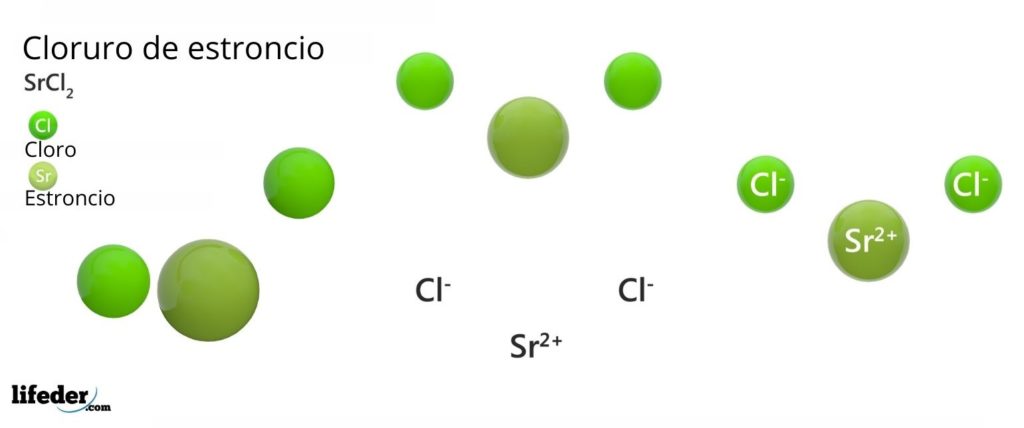
Estructura química del cloruro de estroncio
La imagen superior representa la estructura cristalina tipo rutilo deformada del SrCl2 anhidro. En esta, las esferas verdes pequeñas corresponden a los iones Sr2+, mientras que las esferas verdes voluminosas representan a los iones Cl–.
En esta estructura cada ion Sr2+ está “aprisionado” por ocho iones Cl–, teniendo en consecuencia un número de coordinación igual a 8 y, posiblemente, una geometría cúbica a su alrededor. Es decir, cuatro esferas verdes componen el techo del cubo, mientras que las otras cuatro el piso, ubicándose el Sr2+ en el centro del mismo.
¿Cuál sería la estructura en fase gaseosa? La estructura de Lewis para esta sal es Cl-Sr-Cl, aparentemente lineal y asumiendo una covalencia del cien por ciento de sus enlaces. Sin embargo, en fase gaseosa —SrCl2(g)— esta “línea” muestra un ángulo de aproximadamente de 130 º, siendo en realidad una especie de V.
Esta anomalía no ha podido ser explicada exitosamente, considerando el hecho de que el estroncio no tiene electrones no compartidos que ocupen volumen electrónico. Quizás pueda ser ocasionada por la participación de un orbital d en los enlaces, o a una perturbación núcleo-electrón.
Usos/aplicaciones del cloruro de estroncio
El SrCl2·6H2O se ha utilizado como aditivo en polímeros orgánicos; por ejemplo, en el alcohol polivinílico, con la finalidad de modificar sus propiedades mecánicas y eléctricas.
Se emplea como ferrita de estroncio en la fabricación de imanes de cerámica y de vidrios destinados para hacer el cristal frontal de color de la televisión.
Reacciona con el cromato de sodio (Na2CrO4) para producir cromato de estroncio (SrCrO4), el cual es utilizado como pintura resistente a la corrosión para el aluminio.
Al ser calentados con fuego, los compuestos de estroncio brillan con una llama rojiza, razón por la que son destinados a la elaboración de bengalas y fuegos artificiales.
Aplicaciones medicinales
El radioisótopo de cloruro de estroncio 89 (el isótopo más abundante es el 85Sr) se utiliza en el campo de la medicina para reducir las metástasis óseas, inyectándose vía intravenosa de forma selectiva en el tejido óseo.
El uso de soluciones diluidas (3-5 %) por más de dos semanas en el tratamiento de la rinitis alérgica (inflamación crónica de la mucosa nasal), muestra mejorías en la disminución de los estornudos y el frotamiento nasal.
Una vez fue utilizado en las formulaciones de pasta dentífrica para disminuir la sensibilidad dental, formando una barrera sobre los microtúbulos dentinales.
Estudios de este compuesto demuestran una eficacia terapéutica comparada con la prednisolona (metabolito del fármaco prednisona) en el tratamiento de la colitis ulcerosa.
Sus resultados están basados en el modelo del organismo de las ratas; aun así representa una esperanza para aquellos pacientes que también sufren de osteoporosis, dado que pueden acudir a un mismo medicamento para combatir las dos enfermedades.
Se usa para sintetizar sulfato de estroncio (SrSO4), aún más denso que el SrCl2. Sin embargo, su mínima solubilidad en agua no lo hace suficientemente ligero para ser aplicado en radiología, a diferencia del sulfato de bario (BaSO4).
Preparación del cloruro de estroncio
El cloruro de estroncio puede ser preparado por acción directa del ácido clorhídrico (HCl) sobre el metal puro, ocurriendo así una reacción de tipo redox:
Sr(s) + HCl(ac) => SrCl2(ac) + H2(g)
Aquí, el metal estroncio se oxida donando dos electrones para permitir la formación de hidrógeno gaseoso.
Asimismo, el hidróxido y el carbonato de estroncio (Sr(OH)2 y SrCO3) reaccionan con este ácido al sintetizarlo:
Sr(OH)2(s) + 2HCl(ac) => SrCl2(ac) + 2H2O(l)
SrCO3(s) + 2HCl(ac) => SrCl2(ac) + CO2(g) + H2O(l)
Aplicando técnicas de cristalización, se obtiene el SrCl2·6H2O. Despúes se deshidrata por acción térmica hasta producir finalmente el SrCl2 anhidro.
Propiedades del cloruro de estroncio
Las propiedades físicas y químicas de este compuesto dependen de si se encuentra en su forma hidratada o anhidra. Esto es debido a que las interacciones electrostáticas cambian conforme las moléculas de agua se van adicionando al enrejado cristalino del SrCl2.
Anhidro
El cloruro de estroncio es un sólido cristalino blanco, con un peso molecular de 158,53 g/mol, y una densidad de 3,05 g/mL.
Sus puntos de fusión (874 ºC) y ebullición (1250 ºC) son altos, indicativos de las fuertes interacciones electrostáticas entre los iones Sr2+ y Cl–. Asimismo, refleja la gran energía reticular cristalina que posee su estructura anhidra.
La entalpía de formación del SrCl2 sólido es 828,85 KJ/mol. Esto hace referencia a la energía térmica liberada por cada mol formado a partir de sus componentes en sus estados estándar: gas para el cloro y sólido para el estroncio.
Hexahidrato
En la forma de hexahidrato posee un peso molecular más alto que su forma anhidra (267 g/mol), y una densidad menor (1,96 g/mL). Este descenso en su densidad se debe a que las moléculas de agua “dilatan” los cristales, aumentando el volumen; por ende, disminuye la densidad de la estructura.
Es casi dos veces más denso que el agua a temperatura ambiente. Su solubilidad en agua es muy alta, pero en etanol es ligeramente soluble. Esto es debido a su carácter orgánico a pesar de su polaridad. Es decir, el hexahidrato es un compuesto inorgánico polar. Finalmente, a 150 ºC se deshidrata para producir la sal anhidra:
SrCl2·6H2O(s) => SrCl2(s) + 6H2O(g)
Referencias
- Wikipedia. (2018). Strontium chloride. Recuperado de en.wikipedia.org
- DrugBank. (2018). Strontium chloride Sr-89. Recuperado de drugbank.ca
- Pubchem. (2018). Strontium Chloride. Recuperado de pubchem.ncbi.nlm.nih.gov
- Bull. Mater. (2010). Influence of granular strontium chloride as additives on some electrical and mechanical properties for pure polyvinyl alcohol. Sci., Vol. 33, No. 2, pp. 149–155. Indian Academy of Sciences.
- CCoil. (04 de septiembre de 2009). Strontium-chloride-xtal-3D-SF. [Figura]. Recuperado el 13 de abril de 2018, de: commons.wikimedia.org
- All reactions. SrCl2 – Strontium Chloride. Recuperado de allreactions.com
