Carbono 12: notación nuclear, historia, comentarios
El carbono-12 es el isótopo más abundante del elemento carbono, con un 98,93% de abundancia. Además, es el principal responsable de todas las propiedades y aplicaciones atribuidas al elemento carbono.
El 12C con una masa atómica exactamente de 12 dalton, sirve de referencia para el establecimiento de las masas atómicas del resto de los nucleídos. El átomo de 12C consta de seis protones, neutrones y electrones; sin embargo, la masa de los electrones se considera despreciable.
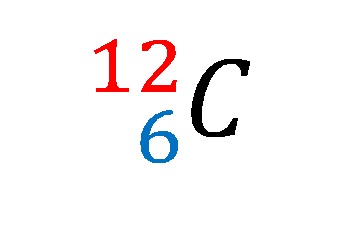
Los elementos suelen tener masas atómicas expresadas como números enteros, seguido de decimales, debido a que los elementos pueden tener varios isótopos estables.
Por lo tanto, las masas atómicas de los elementos son expresadas como el promedio ponderado de las masas atómicas de sus diferentes isótopos. Teniendo en cuenta que el 12C tiene una abundancia de 98,93%, y el 13C una abundancia de 1,15%, la masa atómica del carbono es de 12,011 dalton.
La masa atómica de un elemento se expresa como el promedio de las masas atómicas de sus diferentes átomos en relación a la doceava parte de la masa del 12C, conocida como una unidad de masa atómica unificada; anteriormente abreviada como “uma”, y actualmente como “u”.
Índice del artículo
En la imagen superior se mostró la notación o símbolo nuclear para el isótopo carbono-12.
Describirlo es igual a sentar las características del átomo de carbono por excelencia. Su número atómico 6 señala el número de protones en su núcleo. El número 12 es igual a la sumatoria de los protones y neutrones, y se trata por lo tanto de la masa atómica; la cual, es proporcional a la masa nuclear.
Y aunque esta notación no lo muestre, hay 6 electrones que contrarrestan la carga positiva de los protones en el núcleo. Desde el punto de vista de los enlaces químicos, cuatro de estos seis electrones son los que establecen los cimientos de la vida tal como la conocemos.
Las investigaciones de Dalton (1810) señalaban que el agua contenía un porcentaje de oxígeno del 87,7% y de hidrógeno del 12,5%. Pero, Dalton señaló que la fórmula del agua era OH. Davy y Berzelius (1812) corrigieron la fórmula de agua a H2O.
Posteriormente, Berzelius halló una composición del agua siguiente: oxígeno 88,8% e hidrógeno 11,2%. Consideró que el peso atómico del hidrógeno es de 1 g, y el del oxígeno de 16 g.
Luego, se dieron cuenta que al usar el peso atómico de 1 g para el hidrógeno, el peso atómico del oxígeno sería de 15,9 g. Esta razón, entre otras, llevó a establecer la masa atómica del oxígeno de 16 g como un estándar de referencia para las masas atómicas de los diferentes elementos químicos.
El oxígeno fue usado como patrón de referencia desde finales del siglo XIX hasta 1961, cuando se decidió usar al carbono como estándar de referencia para el establecimiento de las masas atómicas de los diferentes elementos.
Antes de 1959, la IUPAP y la IUPAC usaban al elemento oxígeno para definir el mol de la forma siguiente: 1 mol es el número de átomos de oxígeno presentes en 16 g.
Hablar del 12C es referirse al carbono como un todo; o al menos, el 98% de su esencia, lo cual basta para tal aproximación. Por eso este isótopo carece de uso en sí mismo, mientras que el elemento como tal, y los sólidos que integra, abarcan cientos de aplicaciones.
No obstante, cabe comentar que los organismos vivos tienen especial preferencia por este isótopo que por el 13C; es decir, el porcentaje de 13C o la relación 12C/13C varía en función de los ecosistemas, regiones, o especies animales.
Esto puede deberse quizás a que las moléculas con demasiados átomos de 13C, más pesados, entorpecen o perjudican los procesos metabólicos y el funcionamiento de las células del cuerpo; aun si el porcentaje de 13C en los seres vivos fuera poco superior al 1%.
Por lo tanto, el 12C es el isótopo del carbono responsable de la vida. Y el 14C el “medidor del tiempo” de sus restos, gracias a su decaimiento radiactivo.
Otra utilidad indirecta del 12C es crear “contraste” para la técnica de espectroscopia de resonancia magnética nuclear del 13C, con la cual se puede elucidar (descubrir y construir) la estructura carbonada de compuestos orgánicos.
- Phillips, Basil. (08 de julio de 2019). What Is the Most Common Isotope of Carbon? sciencing.com. Recuperado de: sciencing.com
- César Tomé López. (2019). De los pesos atómicos. Recuperado de: culturacientifica.com
- ElSevier. (2019). Carbon-12. ScienceDirect. Recuperado de: sciencedirect.com
- R. Nave. (s.f.). Nuclear notation. Recuperado de: hyperphysics.phy-astr.gsu.edu
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
