Cromato de zinc: estructura, propiedades, obtención, usos
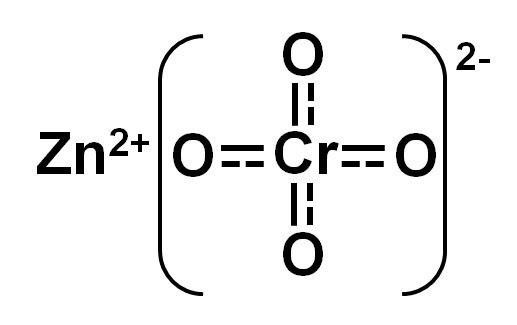
El cromato de zinc o cromato de cinc es un compuesto inorgánico formado por los elementos cinc (Zn), cromo (Cr) y oxígeno (O). Posee los iones Zn2+ y CrO42-. Su fórmula química es ZnCrO4.
El término ‘cromato de cinc’ comercialmente sirve para designar tres compuestos con estructura molecular diferente: (a) el cromato de cinc propiamente dicho ZnCrO4, (b) el cromato básico de cinc ZnCrO4•4Zn(OH)2, y (c) el cromato básico de cinc y potasio 3ZnCrO4•Zn(OH)2•K2CrO4•2H2O.
Se usa principalmente en pinturas o fondos que protegen los metales de la corrosión. Para ello se mezcla con pinturas, barnices y polímeros que luego se aplican sobre la superficie de los metales.
También se utiliza en acabados decorativos y protectores logrados con otros cromatos y ácidos recubriendo diversos objetos tales como herramientas. Asimismo, sirve para retener la conductividad eléctrica de piezas metálicas.
Se emplea como catalizador en reacciones de hidrogenación (adición de hidrógeno) en compuestos orgánicos. Forma parte de pigmentos usados antiguamente en pinturas artísticas.
Es un material que produce cáncer y esto se debe a que el cromato posee el cromo en estado de oxidación +6.
Índice del artículo

El cromato de cinc es un compuesto iónico formado por el catión cinc Zn2+ y el anión cromato CrO42-. Este último está formado por cromo con valencia +6 (cromo hexavalente, Cr6+) y cuatro átomos de oxígeno con estado de oxidación -2.
El ion Zn2+ posee la siguiente estructura electrónica:
1s2, 2s2 2p6, 3s2 3p6 3d10.
Por su parte, el cromo hexavalente tiene en sus orbitales electrónicos la siguiente conformación:
1s2, 2s2 2p6, 3s2 3p6.
Ambas estructuras son muy estables pues los orbitales están completos.
- Cromato de cinc
- Sal de cinc del ácido crómico
- Amarillo de cinc (aunque con este término se denominan también otros compuestos que contienen ZnCrO4).
Sólido cristalino amarillo o amarillo limón. Cristales en forma de prismas.
181,4 g/mol
316 ºC
3,40 g/cm3
Débilmente soluble en agua: 3,08 g/100 g de H2O. Se disuelve fácilmente en ácidos y en amoníaco líquido. Insoluble en acetona.
Según algunas fuentes sus soluciones acuosas son ácidas.
Es un compuesto fuertemente oxidante, por lo que puede reaccionar con agentes reductores generando calor. Entre las sustancias con las que puede reaccionar se encuentran las orgánicas, como los cianuros, ésteres y tiocianatos. También puede atacar algunos metales.
En solución acuosa el ion cromato presenta diversos equilibrios dependiendo del pH y formando diferentes especies.
Por encima de pH 6 está presente el ion cromato CrO42- (de color amarillo); entre pH 2 y pH 6 se encuentran en equilibrio el ion HCrO4– y el dicromato Cr2O72- (de color rojo anaranjado); a pH inferior a 1 la principal especie es H2CrO4.
Cuando a estas soluciones acuosas se añade el catión cinc (II), precipita el ZnCrO4.
Los equilibrios son los siguientes:
HCrO4– ⇔ CrO42- + H+
H2CrO4 ⇔ HCrO4– + H+
Cr2O72- + H2O ⇔ 2 HCrO4–
En medio básico ocurre lo siguiente:
Cr2O72- + OH– ⇔ HCrO4– + CrO42-
HCrO4– + OH– ⇔ CrO42- + H2O
El ZnCrO4 no reacciona rápidamente con el aire ni con el agua.
Se puede producir haciendo reaccionar un lodo acuoso de óxido o hidróxido de cinc con una sal disuelta de cromato y luego neutralizando.
Industrialmente se utiliza el proceso Cronak, en el cual el metal cinc se sumerge en una solución de dicromato de sodio (Na2Cr2O7) y ácido sulfúrico (H2SO4).
También se puede preparar haciéndolo precipitar de soluciones en las que hay sales disueltas de cinc y de cromato:
K2CrO4 + ZnSO4 → ZnCrO4↓ + K2SO4
En la industria metalúrgica se utiliza principalmente en pinturas de fondo (pintura preparatoria o recubrimiento inicial) aplicadas sobre los metales, a los que proporciona resistencia contra la corrosión.
Se emplea como pigmento en pinturas y barnices, siendo insertado en la matriz de un polímero orgánico.
Este tipo de pinturas se administra a tuberías, tanqueros de petróleo, estructuras de acero como puentes, torres de transmisión de energía eléctrica y partes de automóviles para inhibir la corrosión.

También se encuentra protegiendo componentes metálicos recubiertos de cinc que han sido pasivados usando cromatos de metales alcalinos. La pasivación consiste en la pérdida de reactividad química bajo ciertas condiciones ambientales.
Estos recubrimientos también sirven como acabados decorativos y para retener la conductividad eléctrica. Se aplican comúnmente a artículos de uso diario tales como herramientas y se pueden reconocer por su color amarillo.

Ciertos investigadores encontraron que la protección contra la corrosión de los metales que realiza el cromato de cinc podría ser debida a que inhibe el crecimiento de hongos. De esta forma evita el deterioro del recubrimiento de pintura anticorrosiva.
Otros estudios indican que el efecto anticorrosivo podría ser debido a que el compuesto acelera la formación de óxidos protectores sobre los metales.

Este compuesto se ha empleado como catalizador en diversas reacciones químicas, como por ejemplo la hidrogenación del monóxido de carbono (CO) para obtener metanol (CH3OH).
Los ésteres pueden ser convertidos a alcoholes primarios mediante hidrogenación, utilizando este compuesto para acelerar la reacción.
Según algunos investigadores su acción catalítica se debe a que el sólido no presenta una estructura estequiométrica, es decir, se desvía de su fórmula ZnCrO4 y es más bien:
Zn1-xCr2-xO4
Lo que implica que hay defectos en la estructura que favorecen energéticamente la catálisis.
Se encuentra en algunos colorantes aceitosos, sirve para imprimir, es un agente para el tratamiento de superficies, se aplica en recubrimientos de pisos y es un reactivo en laboratorios químicos.
Desde la década del año 1940 se utilizó un derivado del ZnCrO4, el cromato de zinc y cobre, como fungicida foliar para las plantas de papas.

Este uso ya ha sido abandonado por la toxicidad y efectos dañinos del compuesto.
En pinturas artísticas del siglo XIX se ha encontrado la presencia de una sal compleja de cromato de cinc, el 4ZnCrO4•K2O•3H2O (cromato de cinc y potasio hidratado), que es un pigmento amarillo denominado Amarillo Limón.
Aunque no es combustible, al ser calentado emite gases tóxicos. Puede explotar si entra en contacto con agentes reductores o materiales orgánicos.
El polvo irrita los ojos y la piel produciendo reacción alérgica. Su inhalación causa irritación de nariz y garganta. Afecta a los pulmones, causa acortamiento de la respiración, bronquitis, neumonía y asma.
Su ingestión afecta el tracto digestivo, hígado, riñones, sistema nervioso central, produce un colapso circulatorio y daña el sistema inmune.
Es un carcinógeno confirmado, aumenta el riesgo de cáncer pulmonar y de la cavidad nasal. Es tóxico para las células (citotóxico) y además daña los cromosomas (genotóxico).
Se ha determinado que la toxicidad y carcinogenicidad de este compuesto es causada principalmente por la acción del cromo en estado de oxidación +6. Sin embargo, la presencia del cinc le da insolubilidad al producto y esto también influye en el daño que produce.
Es muy tóxico para los animales y para la vida acuática, causando efectos dañinos que perduran en el tiempo. Este químico puede bioacumularse a lo largo de la cadena alimenticia.
Por todas estas razones los procesos que involucran cromatos (cromo hexavalente) están siendo regulados por organizaciones mundiales de salud y sustituidos por técnicas alternas sin este ion.
- U.S. National Library of Medicine. (2019). Zinc chromate. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Lide, D.R. (editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Xie, H. et al. (2009). Zinc Chromate Induces Chromosome Instability and DNA Double Strand Breaks in Human Lung Cells. Toxicol Appl Pharmacol 2009 Feb 1; 234(3): 293-299. Recuperado de ncbi.nlm.nih.gov.
- Jackson, R.A. et al. (1991). The Catalytic Activity and Defect Structure of Zinc Chromate. Catal Lett 8, 385-389 (1991). Recuperado de link.springer.com.
- Yahalom, J. (2001). Corrosion Protection Methods. In Encyclopedia of Materials: Science and Technology. Recuperado de sciencedirect.com.
- Stranger-Johannessen, M. (1988). The Antimicrobial Effect of Pigments in Corrosion Protective Paints. In Houghton D.R., Eggins, H.O.W. (eds) Biodeterioration 7. Recuperado de link.springer.com.
- Barrett, A.G.M. (1991). Reduction. In Comprehensive Organic Synthesis. Recuperado de sciencedirect.com.
- Thurston, H.W. et al. (1948). Chromates as Potato Fungicides. American Potato Journal 25, 406-409 (1948). Recuperado de link.springer.com.
- Lynch, R.F. (2001). Zinc: Alloying, Thermochemical Processing, Properties, and Applications. In Encyclopedia of Materials: Science and Technology. Recuperado de sciencedirect.com.
- Ramesh Kumar, A.V. and Nigam, R.K. (1998). Mössbauer spectroscopy study of corrosion products beneath primer coating containing anticorrosive pigments. J Radioanal Nucl Chem 227, 3-7 (1998). Recuperado de link.springer.com.
- Otero, V. et al. (2017). Barium, zinc and strontium yellows in late 19th-early 20th century oil paintings. Herit Sci 5, 46 (2017). Recuperado de heritagesciencejournal.springeropen.com.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Wikipedia (2020). Zinc chromate. Recuperado de en.wikipedia.org.
- Wikipedia (2020). Chromate conversion coating. Recuperado de en.wikipedia.org.
