Lisina: características, estructura, funciones, biosíntesis
La lisina (Lys, K) o el ácido ε-diaminocapróico, es uno de los 22 aminoácidos que conforman las proteínas de los organismos vivos y, para el ser humano, es considerado como esencial, pues no posee rutas para su biosíntesis.
Fue descubierta por Drechsel en 1889 como producto de la hidrólisis (descomposición) del caseinógeno. Años más tarde, Fischer, Siegfried y Hedin determinaron que también era parte de proteínas como la gelatina, la albúmina de huevo, la conglutina, la fibrina y otras proteínas.
Su ocurrencia fue luego demostrada en plántulas de semillas en germinación y en la mayoría de las proteínas vegetales examinadas, con lo que se determinó su abundancia como elemento constitutivo general de todas las proteínas celulares.
Se considera uno de los principales aminoácidos “limitantes” en las dietas ricas en cereales y por esta razón se piensa que afecta la calidad del contenido proteico consumido por las diferentes poblaciones subdesarrolladas del mundo.
Algunos estudios han determinado que la ingesta de lisina favorece la producción y liberación de las hormonas insulina y glucagón, lo que tiene efectos importantes sobre el metabolismo energético del cuerpo.
Índice del artículo
- 1 Características
- 2 Estructura
- 3 Funciones
- 4 Biosíntesis
- 5 Degradación
- 6 Alimentos ricos en lisina
- 7 Beneficios de su ingesta
- 8 Trastornos por deficiencia de lisina
- 9 Referencias
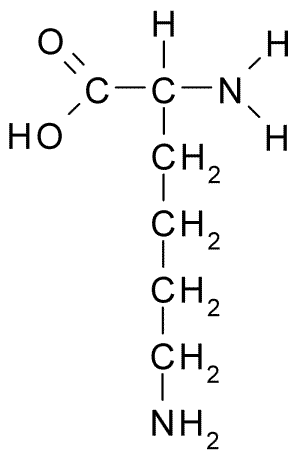
La lisina es un α-aminoácido cargado positivamente, tiene 146 g/mol de peso molecular y el valor de la constante de disociación de su cadena lateral (R) es de 10.53, lo que implica que, a pH fisiológico, su grupo amino sustituyente está completamente ionizado, confiriéndole una carga neta positiva al aminoácido.
Su ocurrencia en las proteínas de distintos tipos de organismos vivos es cercana al 6% y diversos autores consideran que la lisina es imprescindible para el crecimiento y la reparación adecuada de los tejidos.
Las células poseen gran cantidad de derivados de lisina, que cumplen gran diversidad de funciones fisiológicas. Entres estos se encuentran la hidroxilisina, la metil-lisina y otros.
Es un aminoácido cetogénico, lo que implica que su metabolismo produce los esqueletos carbonados de los sustratos intermediarios para las rutas de formación de moléculas como el acetil-CoA, con la posterior formación de cuerpos cetónicos en el hígado.
A diferencia de otros aminoácidos esenciales, este no es un aminoácido glucogénico. En otras palabras, su degradación no termina con la producción de intermediarios de rutas que producen glucosa.
La lisina se clasifica dentro del grupo de los aminoácidos básicos, cuyas cadenas laterales poseen grupos ionizables con cargas positivas.
Su cadena lateral o grupo R posee un segundo grupo amino primario unido al átomo de carbono en la posición ε de su cadena alifática, de allí su nombre “ε-aminocaproico”.
Tiene un átomo de carbono α, al cual se unen un átomo de hidrógeno, un grupo amino, un grupo carboxilo y la cadena lateral R, caracterizada por la fórmula molecular (-CH2-CH2-CH2-CH2-NH3+).
Puesto que la cadena lateral tiene tres grupos metileno, y aunque la molécula de lisina posee un grupo amino con carga positiva a pH fisiológico, este grupo R tiene un fuerte carácter hidrofóbico, por lo que a menudo se encuentra “enterrado” en las estructuras proteicas, dejando fuera solamente al grupo ε-amino.
El grupo amino de la cadena lateral de la lisina es altamente reactivo y, por lo general, participa en los centros activos de muchas proteínas con actividad enzimática.
La lisina, por ser un aminoácido esencial, cumple múltiples funciones como micronutriente, especialmente en humanos y en otros animales, pero también es metabolito en diferentes organismos como las bacterias, las levaduras, las plantas y las algas.
Las características de su cadena lateral, específicamente las del grupo ε-amino unido a la cadena hidrocarbonada que es capaz de formar puentes de hidrógeno, le otorgan propiedades especiales que lo hacen partícipe de las reacciones catalíticas en diversos tipos de enzimas.
Es importantísima para el crecimiento normal y la remodelación de los músculos. Además, es una molécula precursora para la carnitina, un compuesto sintetizado en el hígado, el cerebro y los riñones que se encarga de transportar los ácidos grasos hacia las mitocondrias para la producción de energía.
Este aminoácido también es necesario para la síntesis y formación del colágeno, una importante proteína del sistema de tejidos conectivos en el cuerpo humano, por lo que contribuye al mantenimiento de la estructura de la piel y de los huesos.
Tiene funciones experimentalmente reconocidas en:
– La protección de los intestinos frente a estímulos estresantes, contaminación con patógenos bacterianos y virales, etc.
– Disminuir los síntomas de ansiedad crónica
– Favorecer el crecimiento de infantes que crecen bajo dietas de baja calidad
Los seres humanos y otros mamíferos no pueden sintetizar el aminoácido lisina in vivo y es por esta razón que deben obtenerlo de las proteínas animales y vegetales ingeridas con los alimentos.
En el mundo natural han evolucionado dos rutas diferentes para la biosíntesis de la lisina: una que emplean las bacterias, las plantas y los hongos “inferiores” y otra utilizada por los euglénidos y los hongos “superiores”.
En estos organismos, la lisina es obtenida a partir del ácido diaminopimélico a través de una ruta de 7 pasos que comienzan con piruvato y aspartato semialdehído. Para las bacterias, por ejemplo, esta ruta implica la producción de lisina con propósitos de (1) síntesis proteica, de (2) síntesis de diaminopimelato y de síntesis de (3) la lisina que será utilizada en la pared celular de peptidoglucano.
El aspartato, en los organismos que presentan esta ruta no solo da lugar a lisina, sino que también deriva en la producción de metionina y treonina.
La ruta diverge en el aspartato semialdehído para la producción de lisina y en la homoserina, que es precursora para la treonina y la metionina.
La síntesis de lisina de novo en los hongos superiores y los microorganismos euglénidos ocurre a través del intermediario L-α-aminoadipato, que es transformado numerosas veces de maneras diferentes a las que tienen lugar en las bacterias y en las plantas.
La ruta consiste en 8 pasos enzimáticos, que involucran 7 intermediarios libres. La primera mitad de la ruta tiene lugar en la mitocondria y consigue la síntesis del α-aminoadipato. La conversión del α-aminoadipato en L-lisina ocurre posteriormente en el citosol.
– El primer paso de la ruta consiste en la condensación de las moléculas α-cetoglutarato y acetil-CoA por la enzima homocitrato sintasa, lo que rinde ácido homocítrico.
– El ácido homocítrico es deshidratado en ácido cis-homoaconítico, que luego es convertido en ácido homoisocítrico por una enzima homoaconitasa.
– El ácido homoisocítrico es oxidado por la homoisocitrato deshidrogenasa, con lo que se consigue la formación transitoria de oxoglutarato, que pierde una molécula de dióxido de carbono (CO2) y termina como ácido α-catoadípico.
– Este último compuesto es transaminado por un proceso glutamato-dependiente gracias a la acción de la enzima aminoadipato aminotransferasa, lo que produce ácido L-α-aminoadípico.
– La cadena lateral del ácido L-α-aminoadípico es reducida para formar ácido L-α-aminoadípico-δ-semialdehído por acción de una aminoadipato reductasa, reacción que amerita ATP y NADPH.
– La sacaropina reductasa cataliza entonces la condensación del ácido L-α-aminoadípico-δ-semialdehído con una molécula de L-glutamato. Posteriormente se reduce el imino y se obtiene la sacaropina.
– Finalmente, el enlace carbono-nitrógeno en la porción glutamato de la sacaropina es “cortado” por la enzima sacaropina deshidrogenasa, rindiendo como productos finales L-lisina y ácido α-cetoglutarato.
Ensayos y análisis experimentales realizados con ratas en periodo de crecimiento han permitido dilucidar que la ε-N-acetil-lisina puede reemplazar a la lisina para sustentar el crecimiento de las crías y esto gracias a la presencia de una enzima: la ε-lisina acilasa.
Esta enzima cataliza la hidrólisis de la ε-N-acetil-lisina para producir lisina y lo hace con gran rapidez y en abundantes cantidades.
En todas las especies de mamíferos, el primer paso de la degradación de la lisina es catalizado por la enzima lisina-2-oxoglutarato reductasa, capaz de convertir lisina y α-oxoglutarato en sacaropina, un derivado aminoácidico presente en los fluidos fisiológicos animales y cuya existencia en los mismos fue demostrada a finales de la década de los 60.
La sacaropina es convertida a α-aminoadipato δ-semialdehído y glutamato por acción de la enzima sacaropina deshidrogenasa. Otra enzima también es capaz de emplear sacaropina como sustrato para hidrolizarla a lisina y α-oxoglutarato nuevamente, y esta se conoce como la sacaropina oxidorreductasa.
La sacaropina, uno de los intermediarios metabólicos principales en la degradación de la lisina, tiene una tasa de recambio, en condiciones fisiológicas, sumamente alta, por lo que no se acumula en fluidos o tejidos, lo que ha sido demostrado por las elevadas actividades halladas de sacaropina deshidrogenasa.
Sin embargo, la cantidad y actividad de las enzimas implicadas en el metabolismo de la lisina depende, en gran medida, de diversos aspectos genéticos de cada especie en particular, pues existen variaciones intrínsecas y mecanismos de control o regulación específicos.
Hay una condición patológica relacionada con la pérdida copiosa de aminoácidos como lisina, citrulina e histidina a través de la orina y esta se conoce como “sacaropinuria”. La sacaropina es un derivado aminoácidico del metabolismo de la lisina que es excretado junto con los tres aminoácidos mencionados en la orina de los pacientes “sacaropinúricos”.
La sacaropina fue descubierta inicialmente en la levadura de cerveza y es un precursor de la lisina en estos microorganismos. En otros organismos eucariotas, este compuesto es producido durante la degradación de lisina en las mitocondrias de los hepatocitos
La lisina es obtenida a partir de los alimentos consumidos con la dieta y un ser humano adulto promedio necesita al menos 0.8 g de esta por día. Se encuentra en numerosas proteínas de origen animal, especialmente en las carnes rojas como la de vaca, la de cordero y la de pollo.
Está en pescados como el atún y el salmón y en frutos del mar como las ostras, los langostinos y los mejillones. También está presente en las proteínas constituyentes de los productos lácteos y sus derivados.
En los alimentos de origen vegetal se encuentra en las papas, en los pimientos y en los puerros. Está, igualmente, en los aguacates, los duraznos y las peras. En legumbres como los frijoles arriñonados, los garbanzos y la soya; en las semillas de calabaza, en las nueces de macadamia y en los anacardos (merey, marañón, etc).
Este aminoácido es incluido en numerosos medicamentos de formulación nutracéutica, es decir, aislados a partir de compuestos naturales, especialmente de plantas.
Se emplea como anticonvulsivo y también se ha demostrado su efectividad en la inhibición de la replicación del Herpes Simplex Virus de tipo 1 (HSV-1), que suele manifestarse en momentos de estrés, cuando el sistema inmune está deprimido o “debilitado” como ampollas o herpes en los labios.
La eficacia de los suplementos de L-lisina para el tratamiento del herpes labial se debe a que este “compite” o “bloquea” la arginina, otro aminoácido proteico, que es necesario para la multiplicación del HSV-1.
Se ha determinado que la lisina también tiene efectos anti-ansiolíticos, pues ayuda a bloquear los receptores que están implicados en las respuestas a diferentes estímulos estresantes, además de participar en la disminución de los niveles del cortisol, la “hormona del estrés”.
Algunos estudios han señalado que puede ser útil para la inhibición del crecimiento de tumores cancerígenos, para la salud de los ojos, para el control de la presión arterial, entre otros.
Una estrategia común para tratar infecciones del virus del herpes I en felinos es la suplementación con lisina. Sin embargo, algunas publicaciones científicas establecen que este aminoácido no tiene, en los felinos, ninguna propiedad antiviral, sino que más bien actúa disminuyendo la concentración de arginina.
La ingesta experimental de L-lisina, añadida en la leche de infantes durante el período de lactancia, ha demostrado ser beneficiosa para la ganancia de masa corporal y la inducción del apetito en niños durante los primeros estadios del desarrollo postnatal.
Sin embargo, el exceso de L-lisina puede ocasionar excreciones urinarias exageradas de aminoácidos, tanto de características neutras como básicos, lo que resulta en un desbalance corporal de los mismos.
El exceso de suplementación de L-lisina puede terminar en represión del crecimiento y otros efectos histológicos evidentes en órganos importantes, debido, probablemente, a la pérdida de aminoácidos con la orina.
En el mismo estudio también se evidenció que la suplementación con lisina mejora las propiedades nutricionales de las proteínas vegetales ingeridas.
Otros estudios similares realizado en adultos y niños de ambos sexos en Ghana, Siria y Bangladesh, sacó a relucir las propiedades benéficas de la ingesta de lisina para la reducción de la diarrea en niños y de algunas afecciones respiratorias mortales en hombres adultos.
La lisina es, como todos los aminoácidos esenciales y no esenciales, necesaria para la correcta síntesis de las proteínas celulares que contribuyen a la formación de los sistemas orgánicos corporales.
Marcadas deficiencias de lisina en la dieta, puesto que se trata de un aminoácido esencial que no es producido por el cuerpo, pueden resultar en el desarrollo de cuadros ansiosos mediados por serotonina, además de diarreas, también relacionadas con receptores de serotonina.
- Bol, S., & Bunnik, E. M. (2015). Lysine supplementation is not effective for the prevention or treatment of feline herpesvirus 1 infection in cats: A systematic review. BMC Veterinary Research, 11(1).
- Carson, N., Scally, B., Neill, D., & Carré, I. (1968). Saccharopinuria: a New Inborn Error of Lysine Metabolism. Nature, 218, 679.
- Colina R, J., Díaz E, M., Manzanilla M, L., Araque M, H., Martínez G, G., Rossini V, M., & Jerez-Timaure, N. (2015). Evaluation of Digestible lysine levels in diets with high energy density for finishing pigs. Revista MVZ Córdoba, 20(2), 4522.
- Fellows, B. F. C. I., & Lewis, M. H. R. (1973). Lysine Metabolism in Mammals. Biochemical Journal, 136, 329–334.
- Fornazier, R. F., Azevedo, R. A., Ferreira, R. R., & Varisi, V. A. (2003). Lysine catabolism: Flow, metabolic role and regulation. Brazilian Journal of Plant Physiology, 15(1), 9–18.
- Ghosh, S., Smriga, M., Vuvor, F., Suri, D., Mohammed, H., Armah, S. M., & Scrimshaw, N. S. (2010). Effect of lysine supplementation on health and morbidity in subjects belonging to poor peri-urban households in Accra, Ghana. American Journal of Clinical Nutrition, 92(4), 928–939.
- Hutton, C. A., Perugini, M. A., & Gerrard, J. A. (2007). Inhibition of lysine biosynthesis: An evolving antibiotic strategy. Molecular BioSystems, 3(7), 458–465.
- Kalogeropoulou, D., LaFave, L., Schweim, K., Gannon, M. C., & Nuttall, F. Q. (2009). Lysine ingestion markedly attenuates the glucose response to ingested glucose without a change in insulin response. American Journal of Clinical Nutrition, 90(2), 314–320.
- Nagai, H., & Takeshita, S. (1961). Nutritional effect of L-Lysine supplementation on Growth of Infants and Children. Paediatria Japonica, 4(8), 40–46.
- O’Brien, S. (2018). Healthline. Retrieved September 4, 2019, from www.healthline.com/nutrition/lysine-benefits
- Zabriskie, T. M., & Jackson, M. D. (2000). Lysine biosynthesis and metabolism in fungi. Natural Product Reports, 17(1), 85–97.
