Elemento químico: qué es, tipos, propiedades periódicas, ejemplos
¿Qué es un elemento químico?
Un elemento químico puede definirse como una materia o componente que no puede dividirse y que tiene unas propiedades únicas diferentes a cualquier otro material existente. Según las características de cada elemento, pueden ser más o menos escasos y valiosos.
Para que un elemento químico pueda definirse como tal, debe cumplir la característica de ser indivisible. Es decir, que no puede descomponerse en porciones más pequeñas. Estas partes que no pueden ya dividirse es lo que se conoce como átomos.
Algunos de los elementos químicos pueden compartir compuestos en común, lo que hace que haya cercanía y relación entre estos. Sin embargo, tienen muchas otras partes que no comparten con otros elementos definiéndose así como únicos.
Estas materias químicas pueden estar en estado sólido o gaseoso y se encuentran en diferentes lugares y ambientes alrededor del planeta. Inclusive, estudios científicos han encontrado este tipo de sustancias en elementos externos a la Tierra, como asteroides u otros planetas distantes.
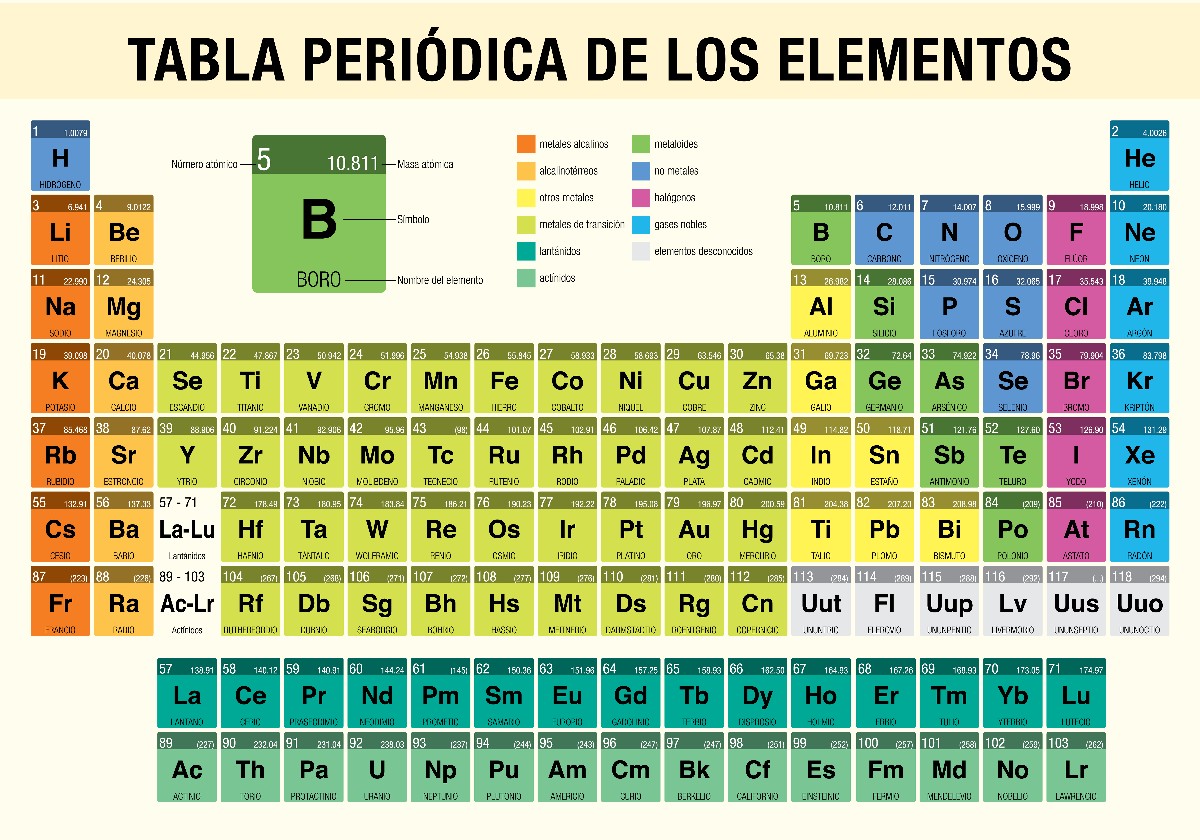
Actualmente se conocen 118 elementos químicos y están organizados según su cantidad de átomos y características en lo que se conoce como tabla periódica.
Tipos de elementos químicos
En la naturaleza pueden encontrarse los elementos químicos definidos anteriormente; sin embargo, muchos de estos pueden estar en estado puro o deben unirse a otros para formar nuevas materias químicas, dando origen así a la clasificación de estos compuestos.
Dentro de los tipos de elementos químicos existen cuatro grandes grupos, que serán explicados a continuación. Sin embargo, hay otros subgrupos más específicos de esta clase de elementos que también serán expuestos.
Metales
Son componentes que se encuentran en su mayoría en estado sólido y debido a sus propiedades son muy buenos conductores de calor y electricidad. Adicionalmente, son elementos que cuentan con un brillo característico, el cual varía su intensidad de acuerdo con cada materia.
Las sustancias clasificadas como metales se caracterizan también por ser muy manejables y dúctiles, permitiendo así que puedan transformarse fácilmente o unirse a otros elementos químicos.
Dentro de los elementos metales, existen seis subgrupos que son:
- Actínidos
- Lantánidos
- Metales de transición
- Alcalinos
- Alcalino-térreos
- Otros metales.
No metales
Estos componentes se encuentran en su mayoría en estado sólido; a pesar de esto se diferencian de los metales, ya que no son buenos conductores de calor ni electricidad y no cuentan con el brillo característico de estos últimos.
Adicionalmente son componentes que no cuentan con la ductilidad y fácil manejo característicos de los metales, por lo que transformarlos es un proceso mucho más complejo.
Metaloides
Puede decirse que estos componentes son una combinación entre elementos metales y no metales, compartiendo características de ambos grupos. Algunos de estos permiten parcialmente la conducción de electricidad y calor y su ductilidad puede ser mayor o menor, dependiendo del elemento químico.
Gases nobles
Son materias químicas que se encuentran en la naturaleza en estado gaseoso y son componentes con características muy especiales y diferentes a cualquier otro elemento gaseoso existente.
Estos elementos se consideran bastante estables y no hacen modificaciones o reacciones químicas con otros elementos para crear nuevas sustancias.
Propiedades periódicas
Como se mencionó anteriormente, todos los elementos químicos existentes se clasifican en lo que se conoce como tabla periódica. Esta tabla no es más que un esquema organizado que ubica por grupos (verticalmente) y periodos (horizontalmente) cada una de las materias químicas según sus características.
Teniendo claro qué es la tabla periódica, pueden definirse entonces las propiedades periódicas. Estas últimas son aquellas características o particularidades que definen cada elemento químico y a su vez establecen su ubicación en la tabla periódica.
Existen cuatro propiedades periódicas principales:
Electronegatividad
Esta propiedad puede ser definida como la capacidad que tiene un componente químico en particular de atraer o enlazar a otros elementos químicos. En otras palabras, la electronegatividad es la fuerza que tienen los átomos de un componente específico, para atraer átomos de otro elemento.
Dentro de la tabla periódica, los elementos que van aumentando su electronegatividad se van ubicando de izquierda a derecha en los periodos y en los grupos de abajo hacia arriba.
Radio atómico
La propiedad de radio atómico no es más que la referencia al tamaño que tienen los átomos que componen cada elemento químico. Es decir, cada materia tiene una cantidad de átomos determinada con tamaños distintos.
En la tabla periódica se van ubicando de arriba hacia abajo a medida que aumenta el tamaño de radio atómico en los grupos y en los periodos disminuye.
Afinidad o estructura electrónica
Puede definirse esta propiedad como el cambio de energía que obtiene un elemento en su estructura atómica al tener algún cambio dentro de la misma.
Dentro de la tabla periódica se ubican en el mismo grupo, ya que tienen en común esta estructura atómica.
Potencial de ionización
Esto se refiere a la energía que requiere la estructura atómica de un elemento en particular para que cambie su estado.
En la tabla periódica, su clasificación se da en un grupo al disminuir de arriba hacia abajo y en los períodos aumentando de izquierda a derecha.
Existen otras propiedades periódicas secundarias como lo son la electropositividad, la densidad atómica, el volumen atómico, temperatura de fusión y temperatura de ebullición.
Ejemplos de elementos químicos
Como se ha mencionado, actualmente hay 118 elementos químicos identificados. Estos elementos tienen un nombre y símbolo únicos que los identifica no solo dentro de la tabla periódica sino en el ámbito científico de la química.
A continuación, se presentarán 50 de estos elementos con sus nombres y símbolos de identificación, los cuales forman parte de los cuatro tipos de elementos mencionados antes.
- Oxígeno (O)
- Flúor (F)
- Neón (Ne)
- Sodio (Na)
- Magnesio (Mg)
- Aluminio (Al)
- Silicio (Si)
- Fósforo (P)
- Azufre (S)
- Cloro (Cl)
- Xenón (Xe)
- Cesio (Cs)
- Bario (Ba)
- Lantano (La)
- Cerio (Ce)
- Praseodimio (Pr)
- Neodimio (Nd)
- Prometio (Pm)
- Samario (Sm)
- Europio (Eu)
- Renio (Re)
- Osmio (Os)
- Iridio (Ir)
- Platino (Pt)
- Oro (Au)
- Mercurio (Hg)
- Talio (Tl)
- Plomo (Pb)
- Bismuto (Bi)
- Polonio (Po)
- Astato (At)
- Radón (Rn)
- Francio (Fr)
- Radio (Ra)
- Actinio (Ac)
- Torio (Th)
- Protactinio (Pa)
- Uranio (U)
- Neptunio (Np)
- Plutonio (Pu)
- Dubnio (Db)
- Seaborgio (Sg)
- Bohrio (Bh)
- Hassio (Hs)
- Meitnerio (Mt)
- Darmstatio (Ds)
- Roentgenio (Rg)
- Copernicio (Cn)
- Flerovio (Fl)
- Livermorio (Lv)
Referencias
- BALL, P. (2019). What is an element? Obtenido de chemistryworld.com
- Periodic Table (2018). Obtenido de rsc.org
- Periodic Table of Elements (2019). Obtenido de pubchem.ncbi.nlm.nih.gov
- Periodic Table of the Elements (2018). Obtenido de sigmaaldrich.com
- What are elements? (2020). Obtenido de bbc.co.uk
