Liasas: funciones y tipos
Las liasas son enzimas que participan en el corte o la adición de grupos en un compuesto químico. El principio de esta reacción se basa en el corte de enlaces C-C, C-O o C-N. En consecuencia, se forman nuevos enlaces dobles o estructuras en anillo (Mahdi and Kelly, 2001).
Por otra parte, las liasas participan en procesos celulares como el ciclo del ácido cítrico y en síntesis orgánica, como por ejemplo la producción de cianohidrinas.
Estas proteínas son diferentes a otras enzimas, ya que presentan ciertos detalles especiales. En un sentido de la reacción actúan sobre dos sustratos, mientras que en la dirección opuesta afectan solo un sustrato.
De hecho, su efecto origina la eliminación de una molécula, que produce una estructura con doble enlace o la aparición de un anillo nuevo. En particular, la enzima ácido poligalacturónico liasa (pectato liasa), que rompe la pectina y origina unidades simples de ácido galacturónico, ramnosa y dextrina. Más aún, está presente en algunos hongos y bacterias fitopatógenos.
Índice del artículo
Las liasas son un grupo interesante de enzimas, que tienen muchos papeles en la vida de nuestro planeta. Así pues, son protagonistas de procesos importantes para la vida de los organismos.
Es decir, la falta de estas proteínas induce la muerte de los seres. En fin, el conocimiento de estas proteínas es divertido e impactante. Por otro lado, enseña la complejidad de los procesos que nos rodean.
Además, sus funciones varían dependiendo del tipo de liasa. En consecuencia, existe una amplia variedad de enzimas con actividad liasa. De tal manera que son capaces de realizar cortes en los enlaces de moléculas muy variables.
Por otra parte, veamos algunos ejemplos de estas proteínas y las funciones que llevan a cabo:
Proporciona a este organismo la capacidad para modificar el aparato digestivo de algunos insectos. Por consiguiente, favorece su rápida multiplicación en todo el cuerpo del animal.
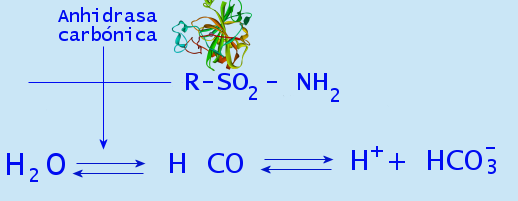
Convierte el dióxido de carbono en bicarbonato y protones. En presencia de agua se encuentra relacionada con el mantenimiento del equilibrio ácido-base en la sangre y en tejidos, así como también en la rápida eliminación del dióxido de carbono de estos.
No obstante, esta enzima en plantas aumenta la concentración de dióxido de carbono en el cloroplasto, lo cual aumenta la carboxilación de la enzima rubisco.
Convierte el 2-fosfoglicerato en fosfoenolpiruvato en la glicólisis. Así como también, puede realizar la reacción inversa en la gluconeogénesis. Evidentemente, busca sintetizar glucosa cuando hay un déficit de este azúcar en las células.
Además de estas funciones clásicas, la enolasa está presente en los axones de células nerviosas. Asimismo, es un marcador de lesiones neuronales y otros daños del sistema nervioso.
Como resultado de su acción, elimina los grupos carboxilo del ácido pirúvico. En consecuencia, lo convierte en etanol y dióxido de carbono.
En levaduras, destruye el CO2 de las células y origina etanol. Este compuesto funciona como antibiótico.
Se localiza en las membranas de los tripanosomas y gran variedad de bacterias. Genera el corte de proteínas del GPI presentes en estas membranas. De hecho, ha sido detectada en Trypanosoma brucei.
Interviene en la gluconeogénesis, convierte oxalacetato en fosfoenolpiruvato y dióxido de carbono. Por otro lado, en animales permite que las células del hígado o riñón formen glucosa a partir de otros metabolitos.
Ejerce su acción en la glicólisis; corta la fructosa-1,6-BF en dos triosas, DHAP y gliceraldehído 3-fosfato. Por tanto, esta enzima ubicada en el citosol de la mayoría de los organismos juega un papel importante en la extracción de energía de azúcares.
Por otra parte, la evaluación de aldolasa sanguínea (o sérica) es una herramienta que permite determinar las estructuras dañadas en órganos como pueden ser el hígado, músculo, riñón o corazón.
Ejerce su acción sobre un sustrato de alquil-mercurio e iones hidrógeno, para producir un alcano e iones de mercurio.
Su papel biológico fundamental es participar en mecanismos de eliminación de tóxicos, porque convierte compuestos orgánicos de mercurio en agentes que no son dañinos.
En particular, transforma el 3-oxomalato en dos productos: el oxoacetato y glioxilato.
Funciona en el ciclo de Krebs, para que los hongos, protistas y plantas formen azúcares a partir de acetatos tomados del medio.
Dentro del grupo de las liasas existen varias subclases:
Estas enzimas cortan enlaces carbono-carbono. Se clasifican en los tipos siguientes:
- Carboxi-liasas: que añaden o quitan COOH. En particular, quitan grupos de aminoácidos, del tipo alfa-ceto-ácidos y beta-ceto-ácidos.
- CHO-liasas: condensa grupos aldol en el sentido inverso.
- Oxo ácido liasas: cortan el 3-ROH ácido o las reacciones inversas.
Liasas carbono-oxígeno
Estas enzimas rompen enlaces C-O. Entre ellas están:
1) Hidroliasas, que eliminan agua. Como son, carbonato o citrato de-hidratasa, fumarato hidratasa, entre otras proteínas.
2) Liasas, que quitan alcohol de azúcares. Se encuentran heparin liasa, pectato liasa, glucuronan liasa, además de muchas otras enzimas (Albersheim 1962, Courtois 1997).
3) Liasas que ejercen su acción sobre sustratos fosfatados y quitan fosfato.
Obviamente, son enzimas que cortan uniones carbono-nitrógeno. Se dividen en:
1) Amonio liasas, que rompen uniones carbono-nitrógeno y forman NH3. Cuya acción es sobre aspartato, treonina o histidina.
2) Además, existen liasas que cortan enlaces C-N en amidas o amidinas. Por ejemplo, adenilosuccinato liasa.
3) Amino-liasas, corta uniones carbono-nitrógeno en grupos aminas. De tal manera que, estricto sidina sintasa, deacetil ipecosido sintasa, están en este grupo de enzimas.
Son enzimas que cortan enlaces carbono-azufre. Por ejemplo, cisteína liasa, lactoilglutationa liasa o metionina γ-liasa.
En primer lugar, esta subclase se estableció originalmente sobre la base de la enzima de eliminación de ácido clorhídrico (HCl) a partir de 1,1,1-tricloro-2,2-bis-etano (DDT).
Fosfolipasa C se encuentra en esta categoría de liasas.
En particular, ejercen su acción sobre uniones carbono-fósforo.
- Mahdi, J.G., Kelly, D.R., 2001. Lyases. In: Rehm, H.-J., Reed, G. (Eds.), Biotechnology Set. Wiley–VCH Verlag GmbH, Weinheim, Germany, pp. 41-171.
- Palomeque P., Martínez M., Valdivia E. y Maqueda M. (1985). Estudios preliminares del efecto entomotóxico de Bacillus laterosporus frente a larvas de Ocnogyna baetica en Jaén. Bol. Serv. Plagas, 11: 147-154.
- Lafrance-Vanasse, J.; Lefebvre, M.; Di Lello, P.; Sygusch, J.; Omichinski, J. G. (2008). Crystal Structures of the Organomercurial Lyase MerB in Its Free and Mercury-bound Forms insights into the mechanism of methylmercury degradation. JBC, 284(2): 938-944.
- Kondrashov, Fyodor A; Koonin, Eugene V; Morgunov, Igor G; Finogenova, Tatiana V; Kondrashova, Marie N. (2006). Evolution of glyoxilate cycle enzymes in Metazoa: evidence of multiple horizontal transfer events and pseudogene formation. Biology Direct, 1:31.
- Albersheim, P. and Killias, U. (1962). Studies relating to the purification and properties of pectin transeliminase. Arch. Biochem. Biophys. 97: 107-115.
- Courtois B, Courtois J (1997). Identification of glucuronan lyase from a mutant strain of Rhizobium meliloti. Int. J. Biol. Macromol. 21(1-2): 3-9.
