Lisozima: características, estrucutra, funciones
Las lisozimas son enzimas hidrolíticas ampliamente distribuidas en la naturaleza capaces de hidrolizar los enlaces glucosídicos del peptidoglucano en la pared de las bacterias. Están presentes en plantas y animales y funcionan como mecanismo de defensa contra infecciones bacterianas.
El descubrimiento de estas enzimas se remonta al año 1922, cuando Alexander Fleming se dio cuenta de que existía una proteína que tenía la capacidad catalítica de lisar bacterias en algunos tejidos y secreciones humanos.
Gracias a su fácil obtención y a su pequeño tamaño, la lisozima fue una de las primeras enzimas secuenciadas y cuya estructura fue determinada a través de rayos X. En la actualidad es empleada como sistema modelo en química, enzimología, cristalografía y biología molecular de proteínas.
La lisozima es una enzima “bacteriolítica” que se especializa en la hidrólisis de los enlaces glucosídicos β-1,4 que se forman entre el ácido N-acetilmurámico y la N-acetilglucosamina presentes en la pared celular de peptidoglucano que está especialmente expuesto en las bacterias grampositivas.
Tiene diversas funciones, tanto digestivas como inmunológicas, en todos los organismos donde se expresa y es empleada como recurso biotecnológico con varios fines.
Índice del artículo
- 1 Características
- 2 Tipos de lisozimas en los animales y sus características
- 3 Estructura
- 4 Funciones
- 5 Referencias
Las lisozimas son expresadas por los principales grupos de organismos vivos en el planeta, pero son particularmente abundantes en animales y es a partir de estos que se han purificado y estudiado más.
En los humanos, la lisozima se encuentra en altas concentraciones en diferentes fluidos y tejidos como el hígado, el cartílago, la saliva, las mucosidades y las lágrimas. Es expresada por las células hematopoyéticas y se encuentra también en los granulocitos, monocitos y macrófagos, así como en otras células precursoras de la médula ósea.
Las lisozimas de origen vegetal hidrolizan sustratos similares a los que emplean otras enzimas muy relacionadas conocidas como quitinasas, por esta razón también pueden hidrolizar enlaces en la quitina, aunque con menor eficiencia.
Al menos tres tipos de lisozimas han sido descritas en el reino animal:
-Las lisozimas tipo C (“C” de “convencional” o de “chicken”, que significa pollo en inglés)
-Las lisozimas tipo G (“G” de “goose”, que significa ganso en inglés) y
-Las lisozimas tipo I (“I” de “invertebrados”)
Las tres clases de lisozimas se diferencian entre sí respecto a sus secuencias aminoacídicas, a sus características bioquímicas y a sus propiedades enzimáticas.
Estas lisozimas son consideradas las enzimas “modelo” de esta familia, puesto que han servido como modelo para los estudios de estructura y función. Se conocen como tipo “C” del inglés “chicken” puesto que fueron aisladas por primera vez de la clara de huevos de gallina.
En esta clase se encuentran las lisozimas producidas por la mayoría de los vertebrados, especialmente por aves y mamíferos. También incluye enzimas presentes en algunos artrópodos como los lepidópteros, los dípteros, algunos arácnidos y crustáceos.
Son enzimas de pequeño tamaño pues tienen un peso molecular que no supera los 15 kDa. Son proteínas básicas con altos puntos isoeléctricos.
La primera lisozima de este tipo fue identificada en la clara de huevo de un ganso y está presente en numerosas especies de aves como las gallinas, los cisnes, los avestruces, los casuarios y otros.
En algunos casos, las lisozimas de tipo G son más abundantes que las lisozimas de tipo C en las claras de los huevos de ciertas aves, mientras que en otros ocurre lo contrario, las lisozimas de tipo C son más abundantes.
Estas lisozimas también están presentes en moluscos bivalvos y en algunos tunicados. Son proteínas un poco más grandes que las de tipo C, pero su peso molecular usualmente no excede los 25 kDa.
Estas lisozimas están presentes primordialmente en animales invertebrados. Su presencia ha sido determinada en anélidos, equinodermos, crustáceos, insectos, moluscos y nemátodos, y está ausente en mamíferos y otros vertebrados.
Tienen puntos isoeléctricos más ácidos que los de las proteínas de tipo C y de tipo G.
Los tres tipos de enzimas animales descritos en la sección anterior presentan estructuras tridimensionales bastante similares.
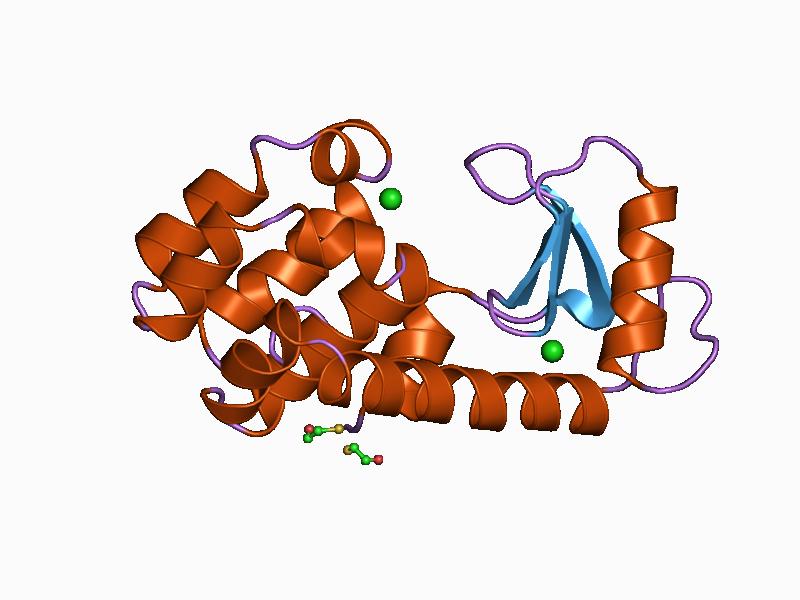
La lisozima de los humanos es una lisozima tipo C y fue la primera de estas enzimas en ser estudiada y caracterizada estructuralmente. Es una pequeña proteína de 130 residuos aminoacídicos y está codificada por un gen ubicado en el cromosoma 12, que posee 4 exones y 3 intrones.
Su estructura se divide en dos dominios: uno conocido como dominio α y otro como dominio β. El dominio α está compuesto por cuatro hélices alfa y el dominio β formado por una lámina β antiparalela y un bucle de gran tamaño.
El sitio catalítico de la enzima se encuentra en la hendidura que se forma entre ambos dominios y para la unión con el sustrato posee residuos de ácido glutámico y ácido aspártico. Además, posee al menos seis “subsitios” conocidos como A, B, C, D, E y F, capaces de unirse a seis residuos consecutivos de azúcares.
La lisozima no solo tiene funciones fisiológicas en la protección y combate contra infecciones bacterianas en los organismos que la expresan, sino que, como se ha comentado, ha sido de gran utilidad como enzima modelo desde el punto de vista químico, enzimático y estructural.
En la industria actual se reconoce como un potente bactericida y se emplea para la preservación de alimentos y fármacos.
Gracias a la reacción que catalizan estas enzimas, pueden actuar sobre distintas poblaciones bacterianas y alterar la estabilidad de sus paredes, lo que se traduce posteriormente en la lisis celular.
En conjunto con otras enzimas similares, las lisozimas pueden actuar tanto sobre bacterias grampositivas como sobre bacterias gramnegativas, por lo que pueden ser consideradas partes del sistema “inmune” antibacteriano de diferentes clases de organismos.
En los glóbulos blancos presentes en la sangre de los mamíferos, estas enzimas tienen importantes funciones en la degradación de los microorganismos invasores, por lo que son esenciales para el sistema inmune de humanos y otros mamíferos.
Las lisozimas en las plantas cumplen esencialmente las mismas funciones que en los animales que las expresan, puesto que están como primera línea de defensa contra patógenos bacterianos.
- Callewaert, L., & Michels, W. (2010). Lysozymes in the animal kingdom. J. Biosci., 35(1), 127–160.
- Merlini, G., & Bellotti, V. (2005). Lysozyme: A paradigmatic molecule for the investigation of protein structure, function and misfolding. Clinica Chimica Acta, 357, 168–172.
- Mir, A. (1977). Lysozyme: a brief review. Postgraduate Medical Journal, 53, 257–259.
- Sahoo, N. R., Kumar, P., Bhusan, B., Bhattacharya, T. K., Dayal, S., & Sahoo, M. (2012). Lysozyme in Livestock : A Guide to Selection for Disease. Journal of Animal Science Advances, 2(4), 347–360.
- Wohlkönig, A., Huet, J., Looze, Y., & Wintjens, R. (2010). Structural Relationships in the Lysozyme Superfamily: Significant Evidence for Glycoside Hydrolase Signature Motifs. PLoS One, 5(11), 1–10.
