Gas ideal: modelo, comportamiento, ejemplos
Un gas ideal o gas perfecto es aquel en el que se considera insignificante la fuerza de atracción o repulsión molecular entre las partículas que lo componen, por lo tanto, toda su energía interna es cinética, es decir, energía asociada al movimiento.
En un gas así, las partículas suelen estar bastante alejadas unas de otras, aunque de vez en cuando chocan entre ellas y con las paredes del recipiente.
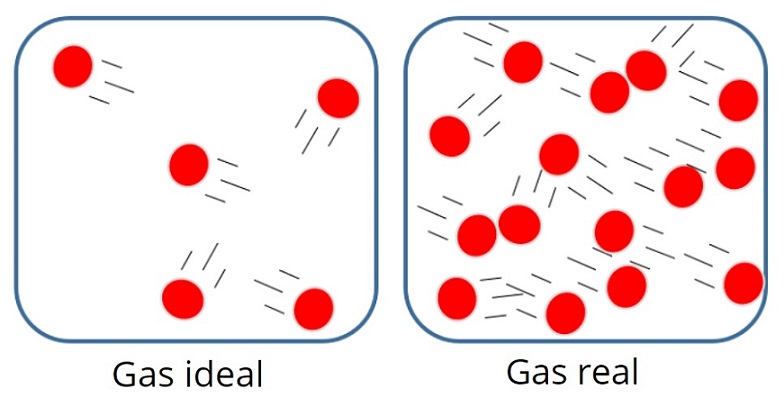
Por otro lado, en el gas ideal tampoco importa el tamaño ni la masa de las partículas, ya que se supone que el volumen ocupado por ellas es muy pequeño en comparación al volumen del gas en sí mismo.
Esta, desde luego, es solo una aproximación, porque en realidad siempre existe algún grado de interacción entre átomos y moléculas. Además sabemos que las partículas sí ocupan espacio y tienen masa.
No obstante estas suposiciones funcionan bastante bien en muchos casos, como por ejemplo en gases de bajo peso molecular, en un buen rango de presiones y temperaturas.
Sin embargo, gases de elevado peso molecular, sobre todo a altas presiones o bajas temperaturas, no se comportan en lo absoluto como gases ideales y se necesita de otros modelos creados con el propósito de describirlos con mayor precisión.
Índice del artículo
- 1 Primeros experimentos
- 2 Modelo de gas ideal
- 3 Comportamiento de un gas ideal
- 4 Ejemplos de gases ideales
- 5 Referencias
Las leyes que rigen los gases son empíricas, es decir, surgieron de la experimentación. Los experimentos más notables se realizaron a lo largo de los siglos XVII, XVIII y comienzos del siglo XIX.
En primer lugar están los de Robert Boyle (1627-1691) y Edme Mariotte (1620-1684), quienes independientemente modificaron la presión en un gas y registraron su cambio de volumen, hallando que eran inversamente proporcionales: a mayor presión, menor volumen.

Por su parte, Jacques Charles (1746-1823) estableció que el volumen y la temperatura absoluta eran directamente proporcionales, siempre y cuando la presión se mantuviera constante.
Amadeo Avogadro (1776-1856) descubrió que dos volúmenes idénticos de diferentes gases contenían la misma cantidad de partículas, siempre y cuando la presión y la temperatura fueran las mismas. Y finalmente Joseph de Gay Lussac (1778-1850), afirmó que al mantener fijo el volumen, la presión en un gas es directamente proporcional a la temperatura.
Estos descubrimientos se expresan mediante sencillas fórmulas, llamando p a la presión, V al volumen, n al número de partículas y T la temperatura del gas ideal:
Ley de Boyle-Mariotte
Siempre que la temperatura se encuentre fija, ocurre lo siguiente:
p⋅V = constante
Ley de Charles
Cuando el gas está bajo presión constante:
V / T = constante
Ley de Gay Lussac
Manteniendo el gas a un volumen fijo se cumple que:
p / T = constante
Ley de Avogadro
Volúmenes idénticos de gas, bajo las mismas condiciones de presión y temperatura tienen el mismo número de partículas. Por lo tanto podemos escribir:
V ∝ n
Donde n es el número de partículas y ∝ es el símbolo de proporcionalidad.
El modelo de gas ideal describe un gas tal que:
-Cuando las partículas interactúan lo hacen por muy breve tiempo, mediante choques elásticos, en los que se conservan el ímpetu y la energía cinética.
-Sus partículas constituyentes son puntuales, en otras palabras, su diámetro es mucho menor que la distancia promedio que recorren entre una y otra colisión.
-Las fuerzas intermoleculares son inexistentes.
-La energía cinética es proporcional a la temperatura.
Gases monoatómicos -cuyos átomos no están ligados entre sí- y de bajo peso molecular, en condiciones estándar de presión y temperatura (presión atmosférica y 0 º C de temperatura), tienen un comportamiento tal que el modelo de gas ideal es una muy buena descripción para ellos.
Las leyes de los gases antes enunciadas se combinan para formar la ecuación general que rige el comportamiento del gas ideal:
V ∝ n
V ∝ T
Por lo tanto:
V ∝ n⋅T
Además, de la ley de Boyle:
V = constante / p
Entonces podemos afirmar que:
V = (constante x n⋅T) / p
La constante se llama la constante de los gases y se denota mediante la letra R. Con esta elección, la ecuación de estado del gas ideal relaciona cuatro variables que describen el estado del gas, a saber n, R, p y T, quedando:
p⋅V = n⋅R⋅T
Esta ecuación, relativamente sencilla, es consecuente con las leyes de los gases ideales. Por ejemplo, si la temperatura es constante, la ecuación se reduce a la ley de Boyle-Mariotte.
Como hemos dicho antes, en condiciones estándar de temperatura y presión, esto es, a 0ºC (273.15 K) y 1 atmósfera de presión, el comportamiento de muchos gases es cercano al del gas ideal. Bajo estas condiciones, el volumen de 1 mol del gas es de 22.414 L.
En tal caso:
R = (p⋅V) / (n⋅T) = (1 atm x 22.414 L) / (1 mol x 273.15 K) = 0.0821 atm ⋅ L /mol ⋅ K
La constante de los gases también se puede expresar en otras unidades, por ejemplo en el Sistema Internacional SI vale:
R = 8,314 J⋅ mol-1⋅ K-1
Cuando se resuelve un problema mediante la ley de los gases ideales, es conveniente prestar atención a las unidades en las que se expresa la constante, ya que como podemos ver, hay muchas posibilidades.
Como hemos dicho, cualquier gas en condiciones estándar de presión y temperatura y que sea de bajo peso molecular, se comporta de manera muy cercana al gas ideal. Por lo tanto, la ecuación p⋅V = n⋅R⋅T es aplicable para encontrar la relación entre las cuatro variables que lo describen: n, p, V y T.
De esta manera podemos imaginar una porción de gas ideal encerrado en un recipiente y formado por diminutas partículas, que de vez en cuando colisionan entre sí y con las paredes del recipiente, siempre de forma elástica.
Es lo que vemos en la siguiente animación de una porción de helio, un gas noble y monoatómico:

Un gas ideal es un gas hipotético, es decir, se trata de una idealización, sin embargo, en la práctica muchos gases se comportan de una forma muy cercana, haciendo posible que el modelo p⋅V = n⋅R⋅T arroje resultados muy precisos.
Ejemplo de gases que se comportan como ideales bajo condiciones estándar son los gases nobles, así como los gases ligeros: hidrógeno, oxígeno y nitrógeno.

Al globo aerostático de la figura 1 se le puede aplicar la ley de Charles: el gas se calienta, por lo tanto el aire que llena el globo se expande y como consecuencia este se eleva.
El helio es, junto con el hidrógeno, el elemento más común en el universo, y sin embargo es escaso en la Tierra. Como es un gas noble es inerte, a diferencia del hidrógeno, por eso los globos llenos de helio son muy utilizados como elementos decorativos.
- Atkins, P. 1999. Química Física. Ediciones Omega.
- Chang, R. 2013. Química. 11va. Edición. Mc Graw Hill Educación.
- Cengel, Y. 2012. Termodinámica. 7ma Edición. McGraw Hill.
- Cimbala, C. 2006. Mecánica de Fluidos, Fundamentos y Aplicaciones. Mc. Graw Hill.
- Giambattista, A. 2010. Physics. 2nd. Ed. McGraw Hill.
