Metales: propiedades, tipos, usos, ejemplos
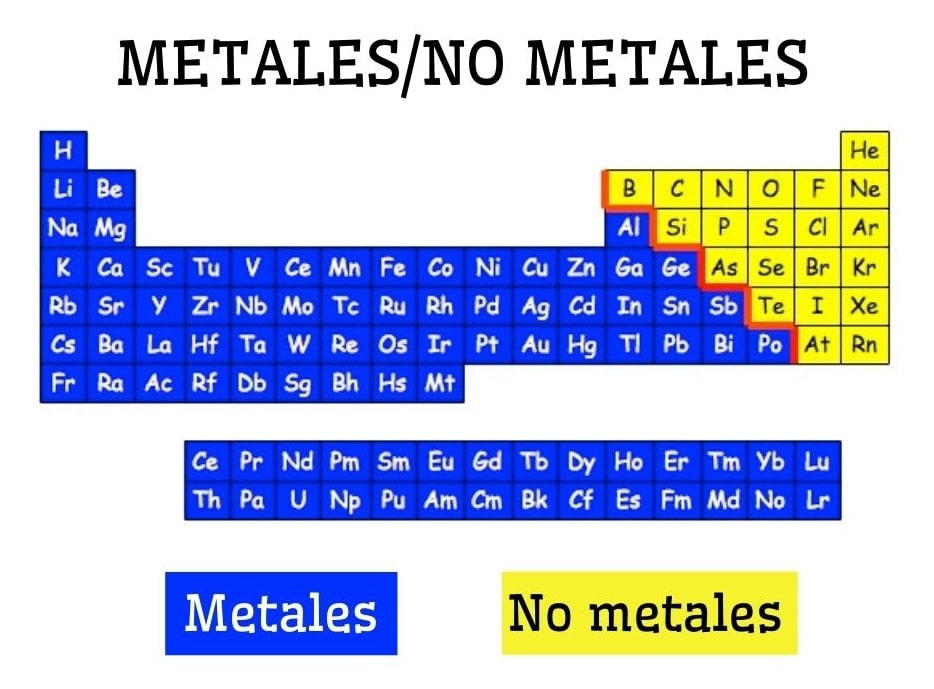
¿Qué son los metales?
Los metales están formados por un grupo de elementos que se ubican en el lado izquierdo, con la excepción del no metal hidrógeno, de la tabla periódica. Los metales constituyen cerca del 75 % de los elementos químicos, por lo que puede afirmarse que gran parte de la naturaleza es de carácter metálico.
Los metales que el hombre procesó inicialmente en la prehistoria fueron los siguientes: el oro, la plata, el cobre, el estaño, el plomo y el hierro. Esto se debió a que se hallaban en estado nativo o a la facilidad de su procesamiento para realizar objetos de utilidad.
Parece cosa de magia que de montones de rocas y minerales puedan extraerse cuerpos lustrosos y plateados (con ciertas importantes y destacadas excepciones). Tal es el caso de la bauxita y el aluminio, de cuyas rocas arcillosas se obtenga este metal reducido en láminas o papeles plateados.
Los metales son el armazón de las industrias; sus cableados, reactores, unidades, contenedores, todas de algún modo u otro se componen de metales y sus aleaciones.
Con los metales se hicieron las primeras monedas, armas, herramientas, armaduras, para luego emplearse en las fabricaciones de vehículos, bicicletas, barcos, aviones, computadoras, entre otros objetos indispensables en la vida moderna.
Historia
Edad del Cobre
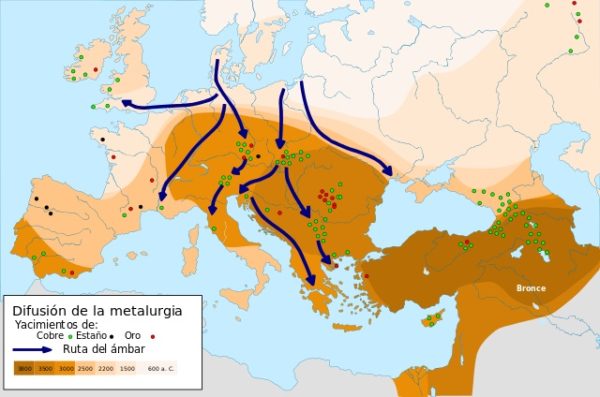
En el 9000 a.C. se elaboraron los primeros objetos metálicos de cobre forjado en el Cercano Oriente, cuando el hombre descubrió que al martillar el cobre aumentaba su fortaleza y resistencia, usándolo para la fabricación de cuchillos. Esta es la Edad del Cobre.
Se descubrió que se podía obtener cobre mediante el calentamiento de minerales azules, como la corvellita y la malaquita (4000-3000 a.C.).
El período calcolítico es un lapso de tiempo que precede a la Edad de Bronce, correspondiente a 5000-3000 a.C. El hombre comenzó a experimentar con la fusión y fundición del cobre, para obtener así cobre forjado a partir de óxido de cobre.
Edad del Bronce (3000-1500 a.C.)

El hombre probablemente en forma accidental comenzó la elaboración de aleaciones, inicialmente de cobre y arsénico, y luego con cobre y estaño para obtener el bronce en el Cercano Oriente.
Los artículos de bronce, correspondientes a esta época, tenían un 87 % de cobre, 11 % de estaño y pequeñas cantidades de hierro, arsénico, níquel, plomo y antimonio.
Edad del hierro (700 a.C.)
El hombre utilizó su experiencia en la producción de cobre forjado para la producción del hierro forjado en el Cercano Oriente. En ese mismo período de tiempo se produjo la granulación de polvo Etrusco, Italia.
La primera producción conocida de acero, una aleación de hierro y carbono, se manifestó en piezas del metal en un sitio arqueológico de Anatolia (1800 a.C.)
Hacia el año 1122 d.C., en una fecha y lugar desconocidos, se introduce el hierro fundido. En el año 1440 d.C. se produce la Gran Campana de Beijing, China. Casi tres siglos después, en 1709 d.C., se produce el hierro fundido usando el coque como material combustible.
En 1779 se utiliza el hierro fundido en Inglaterra como material arquitectónico. En 1855, Henry Bessenir usó el arrabio como materia prima para la obtención del acero suave. Los ingleses Clark y Wood (1872) patentan una aleación, considerada actualmente como acero inoxidable.
Propiedades físicas de los metales

Entre algunas propiedades físicas de los metales tenemos:
-Los metales son de apariencia brillante y son capaces de reflejar la luz.
-En general, son buenos conductores de la electricidad y del calor.
-Presentan puntos de fusión y ebullición altos.
-Son maleables, es decir, que pueden ser martillados para producir láminas de bajo espesor.

-Son dúctiles, con ellos se pueden fabricar alambres o fibras de muy poco diámetro.
-Se presentan en estado sólido, a excepción del mercurio que a temperatura ambiente se encuentra en estado líquido, y el galio, el cual se funde con solo apretarlo entre las manos. En la siguiente imagen se puede observar un recipiente de mercurio:

-Son cuerpos opacos, sus láminas delgadas no son atravesadas por la luz.
-Presentan una gran dureza, a excepción del sodio y el potasio que pueden ser cortados por un cuchillo.
-Poseen una densidad alta, siendo el osmio y el iridio los de mayor densidad, y el litio el de menor densidad.
Propiedades químicas de los metales
Entre algunas de las propiedades químicas de los metales tenemos:
-Tienden a perder electrones y formar cationes metálicos, Mn+, donde n indica su número de oxidación, el cual solo para metales alcalinos y alcalinotérreos coincide con su número de valencia.
-Sus electronegatividades son bajas.
-Se corroen y experimentan daño por oxidación.
-Forman óxidos básicos al reaccionar con el oxígeno. Estos óxidos al combinarse con el agua forman hidróxidos metálicos. Los óxidos metálicos reaccionan con los ácidos para formar sales y agua.
-Son buenos agentes reductores, ya que ceden sus electrones.
Tipos de metales
Los metales se clasifican en los siguientes: alcalinos, alcalinos-térreos, postransicionales, transicionales y las llamadas tierras raras.
Metales alcalinos

No suelen encontrarse libres en la naturaleza porque se oxidan fácilmente. Tienen un suborbital s1 en su capa orbital externa, por lo que tienen un estado de oxidación +1. Son metales que reaccionan exotérmicamente con el agua y son fuertemente reductores.
Metales alcalino-térreos
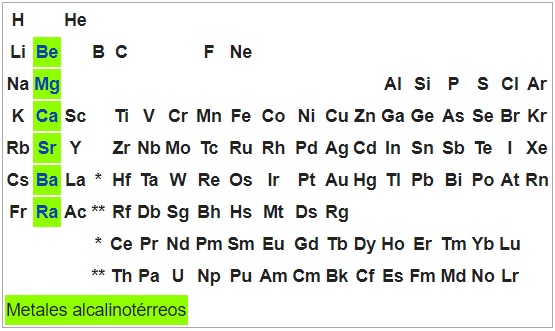
Son metales maleables y dúctiles. Los átomos de los elementos de este grupo tienen una configuración s2, por lo que pueden ceder dos electrones y su estado de oxidación es +2. A excepción del berilio, son oxidables por exposición al aire.
Metales postransicionales
Son metales del llamado bloque p, ubicado entre los metales de transición y los metaloides en la tabla periódica.
Los elementos del grupo 3 tienen los estados de oxidación +1 y +3 como los más comunes, aunque el aluminio solo presenta el estado de oxidación +3. También forma parte de los metales postransicionales algunos ubicados en los grupos 14 y 15.
Metales de transición d
Forman un grupo que se encuentran entre los elementos formadores de bases y los formadores de ácidos. Los orbitales atómicos d y f están incompletos y se están llenando. Aunque el término de metales de transición se refiere a los metales de transición d.
Los metales de transición presentan más de un estado de oxidación. Tienen puntos de fusión y ebullición más altos que otros grupos de metales. Los metales de transición es un grupo de metales muy heterogéneo que comprende, entre otros, el hierro, el cromo, la plata, etc.
Tierras raras

Este grupo de metales está conformado por los elementos escandio e itrio y los elementos de la serie de los lantánidos y actínidos. El término ‘tierras raras’ se refiere a que no se encuentran en la naturaleza en estados puros y son atacables por ácidos.
Usos/aplicaciones de los metales
Metales alcalinos
El litio se usa como medio de transferencia de calor en algunos reactores nucleares. Se emplea en algunas pilas secas y acumuladores de poco peso. El cloruro y el bromuro de litio son compuestos higroscópicos que se usan en procesos industriales de secado y en aire acondicionado.
El sodio se utiliza en la metalurgia de metales, tales como el titanio y el zirconio. Se emplea en el alumbrado público en las lámparas de arco de sodio. El cloruro de sodio (NaCl) se emplea como saborizante de alimentos y para la preservación de la carne.
Metales alcalinotérreos
El magnesio se empleaba en la fotografía como luz de destello y en fuegos artificiales. El bario es componente de aleaciones que se usan en bujías por la facilidad del elemento para emitir electrones. Se usan sales de bario para limitar el daño ocasionado por los rayos X en las placas del tracto gastrointestinal.
El calcio se usa para eliminar impurezas disueltas en metales fundidos y en la eliminación de gases residuales en tubos de vacío. Forma parte del yeso, material usado en construcción y en el tratamiento de fracturas óseas.
Metales postransicionales
El aluminio debido a que es un metal liviano se usa en la construcción de aviones y embarcaciones. También se emplea en la elaboración de numerosos utensilios de cocina. Se emplea como materia prima en la fabricación de desodorantes que limitan la sudoración.
El galio se utiliza en transistores y termómetros para altas temperaturas. El isótopo 67Ga se usa en medicina en el tratamiento de algunos melanomas. El plomo se utiliza en la construcción de baterías y en la protección contra radiaciones ionizantes.
Metales transicionales
El cobre es utilizado en las tuberías de suministro de agua, en los refrigeradores y sistemas de aire acondicionado. También se usa como parte del mecanismo de disipación de calor de los ordenadores. Se usa en la conducción de la corriente eléctrica, en electroimanes y en la coloración de vidrios.
El níquel se utiliza en la elaboración del acero inoxidable, así como de cuerdas de guitarra y baterías recargables. También es usado en galvanoplastia en la protección de metales. Es utilizado en aleaciones que se encuentran en partes de vehículos, como válvulas, rodamientos y frenos.
El níquel ha sido usado, desde hace mucho tiempo en la elaboración de monedas.
El zinc se usa en la protección metales contra la corrosión, en la producción del latón. El óxido de zinc y el sulfato de zinc se emplean en la fabricación de planchas utilizadas en tejados, canalones y bajantes.
El cromo se utiliza en la protección contra la corrosión de metales y les suministra brillo. Se emplea como catalizador en la reacción de síntesis del amoníaco (NH3). El óxido de cromo se utiliza en la protección de la madera.
Tierras raras
El escandio se usa en aleaciones con aluminio para componentes aeroespaciales. Es un aditivo en lámparas de vapor de mercurio.
El lantano se emplea en vidrios de alto índice de refracción y resistentes al álcalis. Además, se emplea en la fabricación de lentes de cámaras y como catalizador de craqueo catalítico de fluidos para refinerías de petróleo.
El cerio se utiliza como agente oxidante químico. Adicionalmente, se emplea para el suministro de una coloración amarilla en vidrio y cerámica, así como catalizador para hornos autolimpiantes.
Ejemplos de elementos metálicos
Alcalinos
Sodio (Na), potasio (K), cesio (Cs), litio (Li) y rubidio (Ru).
Alcalinos-térreos
Berilio (Be), magnesio (Mg), calcio (Ca), estroncio (Sr), bario (Ba) y radio (Ra).
Postransicionales
Aluminio (Al), galio (Ga), Indio (In), talio (Tl), estaño (Sn) y plomo (Pb).
Transicionales
Titanio (Ti), vanadio (V), cromo (Cr), manganeso (Mn), hierro (Fe), cobalto (Co), Níquel (Ni), cobre (Cu), zinc (Zn), zirconio (Zr), niobio (Nb), molibdeno (Mo), paladio (Pd), plata (Ag), volframio (W), renio (Re), osmio (Os), iridio (Ir),
Platino (Pt), oro (Au) y mercurio (Hg).
Tierras raras
Escandio (Sc), itrio (Y), lantano (La), cerio (Ce), praseodimio (Pr), neodimio (Nd), samario (Sm), europio (Eu), gadolinio (Gd), holmio (Ho), erbio (Er), tulio (Tm), iterbio (Yb) y lutecio (Lu).
Referencias
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Helmenstine, Anne Marie, Ph.D. (05 de octubre de 2019). Metals Versus Nonmetals. Recuperado de: thoughtco.com
- Metals And Their Properties- Physical and Chemical. [PDF]. Recuperado de: csun.edu
- Jonathan Maes. (2019). 18 Different Types of Metal (Facts and Uses). Recuperado de: makeitfrommetal.com
