Ácido sulfámico: estructura, propiedades, síntesis, usos
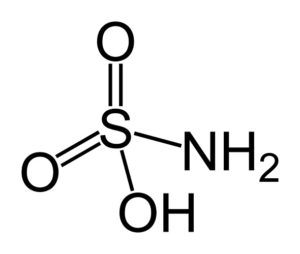
El ácido sulfámico es un compuesto inorgánico formado por un átomo de azufre (S) unido de forma covalente y por enlace simple a un grupo hidroxilo (–OH) y a un grupo amino (–NH2), y por enlace doble a dos átomos de oxígeno (O). Es un sólido cristalino blanco. Su fórmula química es NH2SO3H. También se le conoce como ácido aminosulfónico, ácido amidosulfónico, ácido amidosulfúrico y ácido sulfamídico.
El ácido sulfámico es un ácido fuerte. Puede reaccionar con metales, óxidos de metales y carbonatos. Sus sales son generalmente solubles en agua, por lo que es buen removedor de incrustaciones en equipos de procesos. Es utilizado con frecuencia en los ingenios azucareros para limpiar incrustaciones de carbonatos en los equipos evaporadores.
El ácido sulfámico es un reductor de nitritos (NO2–) y esta propiedad química es empleada en varias aplicaciones, como en la industria de los colorantes y en el análisis de nitritos.
Tiene uso en el curtido de cuero y en el blanqueamiento de la pulpa para la fabricación de papel. De hecho, es un contaminante de los alimentos, pues muchas veces se encuentra en los papeles y cartones que se emplean para empacar los comestibles.
También se emplea en electrodeposición de metales, como patrón de laboratorio y uno de sus derivados es un herbicida muy efectivo.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades
- 4 Síntesis
- 5 Usos
- 5.1 En la industria de los colorantes
- 5.2 En el procesamiento de cuero
- 5.3 En limpieza de equipos de procesos
- 5.4 En refinación de metales
- 5.5 Como reactivo patrón en laboratorio
- 5.6 En el análisis de nitritos
- 5.7 En el análisis de oxígeno disuelto en agua
- 5.8 En la preparación de óxido nitroso
- 5.9 En agricultura
- 5.10 En telas a prueba de fuego
- 5.11 En diversas aplicaciones
- 6 Referencias
El ácido sulfámico cristaliza en forma de cristales ortorrómbicos bipiramidales. Forma prismas compactos y láminas cuando cristaliza desde solución fría, así como láminas de rombo cuando lo hace de solución acuosa caliente.
– Ácido sulfámico
– Ácido aminosulfónico
– Ácido amidosulfónico
– Ácido amidosulfúrico
– Ácido sulfamídico
Sólido cristalino blanco.
97,1 g/mol.
205 ºC, se descompone a 209 ºC.
2,15 g/cm3
Soluble en agua:
– 12,8% a 0 ºC
– 17,57% a 20 ºC
– 22,77% a 40 ºC
Escasamente soluble en metanol, ligeramente soluble en acetona, insoluble en éter.
Libremente soluble en bases nitrogenadas y en solventes orgánicos que contienen nitrógeno.
Insoluble en disulfuro de carbono (CS2) y tetracloruro de carbono (CCl4).
0,41 (en solución 1 N, esto es, 1 equivalente/L).
0,101 a 25 ºC.
Es un ácido fuerte. Casi tanto como los ácidos clorhídrico (HCl), nítrico (HNO3) y sulfúrico (H2SO4).
Las soluciones acuosas del ácido sulfámico están altamente ionizadas. Sus pH son más bajos que las soluciones de los ácidos fórmico, fosfórico y oxálico.
En agua, el ácido sulfámico pierde solamente el protón que está unido al oxígeno. Los hidrógenos unidos al nitrógeno se mantienen firmemente unidos.
En solución acuosa se hidroliza lentamente para dar sulfato ácido de amonio (NH4HSO4). Es estable en condiciones secas.
El ácido sulfámico ataca los metales, óxidos de metales y carbonatos para generar sulfamatos. Por ejemplo, con el metal potasio (K) forma sulfamato de potasio (KOSO2NH2) e hidrógeno (H2).
Todas las sales del ácido sulfámico son solubles en agua. Las sales de calcio, plomo y bario son muy solubles en agua, al contrario de las correspondientes del ácido sulfúrico.
El ácido nitroso (HNO2) reacciona cuantitativamente con el grupo amino del ácido sulfámico, liberando nitrógeno (N2). Se estima que el ion sulfamato funciona en esta reacción como una amida, no como una amina.
El ácido sulfámico es oxidado por cloro, bromo o clorato de potasio para convertirlo en ácido sulfúrico. Esta reacción no ocurre con otros oxidantes como el ácido crómico ni el permanganato de potasio.
No es compatible (reacciona) con álcalis fuertes, cloro, ácido hipocloroso, hipocloritos, cianuros y sulfuros.
No es higroscópico (esto significa que no absorbe humedad del aire).
Cuando se calienta hasta descomposición emite humos altamente tóxicos de óxidos de azufre y cloruro de hidrógeno (HCl).
Uno de sus derivados, el sulfamato de amonio, es un retardador del fuego.
Es moderadamente tóxico.
El ácido sulfámico se obtiene mediante la reacción de urea CO(NH2)2 con ácido sulfúrico fumante, esto es, ácido sulfúrico (H2SO4) concentrado que contiene trióxido de azufre (SO3).
También se puede sintetizar haciendo reaccionar ácido clorosulfónico (HClO3Cl) y amoníaco (NH3).
El ácido sulfámico se emplea para remover el exceso de nitritos de forma rápida y efectiva en las reacciones de diazotización en la síntesis de colorantes. Resulta mucho más práctico que la urea para este propósito.
Durante el curtido de cuero, el empleo del ácido sulfámico en lugar del ácido sulfúrico proporciona una textura más fina y sedosa.
Además, dado que el sulfamato de calcio es soluble en agua, al contrario del sulfato de calcio, el ácido sulfámico puede emplearse en el proceso de desencalado sin dejar las manchas que a veces ocurren en el cuero cuando se usa el ácido sulfúrico.

El ácido sulfámico se utiliza como limpiador descalcificador en hervidores, reactores, tuberías, sistemas de enfriamiento e intercambiadores de calor.
En estos equipos se forman incrustaciones por la circulación de agua o compuestos del proceso en plantas de energía, plantas químicas, acerías, fábricas de papel, estaciones de compresión y otras industrias.
Las incrustaciones o depósitos sólidos pueden ser orgánicos (algas, limo, hongos) o inorgánicos (óxidos de hierro, sulfuros de hierro, carbonatos de calcio o magnesio, sulfatos, fosfatos o silicatos).
El ácido sulfámico es muy efectivo cuando se usa para eliminar incrustaciones de carbonato de calcio. Puede usarse en equipos de cobre, latón, acero inoxidable, hierro colado y acero galvanizado.
Se emplea en forma de solución al 5-10% en peso. Se usa especialmente en ingenios azucareros para limpiar los evaporadores hechos de hierro colado con intercambiadores de calor de cobre.

Debe usarse a temperaturas no mayores a 50-60 ºC. Temperaturas de 70 ºC conducen a la formación de sulfatos insolubles como el CaSO4.
Cuando se usa combinado con cloruro de sodio, ocurre un efecto de sinergia y la solución permite disolver lentamente el óxido férrico. En este caso no se debe usar con acero inoxidable porque se libera ácido clorhídrico, el cual puede causar corrosión en ese material.
La electrodeposición de metales como cobre, plata, cobalto, níquel, cinc, cadmio, hierro y plomo puede realizarse con éxito en soluciones de ácido sulfámico. Este puede ser manejado con mucha mayor facilidad que el ácido hidrofluorosilícico (H2SiF6).
Dadas ciertas características del ácido sulfámico como son: su fuerza como ácido, su facilidad para ser purificado por recristalización en agua, su estabilidad y su no-higroscopicidad, se ha utilizado como estándar primario a nivel de laboratorio. Esto significa que se utiliza para determinaciones cuantitativas de álcalis.

Por su fácil reacción con los nitritos, el ácido sulfámico se emplea para la determinación de estos en solución.
Dado que al reaccionar el ácido sulfámico con los nitritos del agua se libera nitrógeno, es posible efectuar la determinación de oxígeno disuelto en agua, pues se elimina la interferencia causada por los nitritos.
El ácido sulfámico reacciona con ácido nítrico generando óxido nitroso (N2O). Esta reacción es más segura que la de nitrato de amonio para obtener dicho gas.
Un derivado del ácido sulfámico, el sulfamato de amonio, es un efectivo herbicida no tóxico para los animales.
Se aplica por rocío en las hojas de las especies a eliminar al final del verano o inicios del otoño, preferiblemente en clima húmedo. Al trasladarse el compuesto desde las hojas hasta las raíces, la planta muere.

Otra ventaja de este compuesto es que no esteriliza permanentemente el suelo. En efecto, algo del nitrógeno del sulfamato de amonio estará disponible en el suelo para crecimiento de plantas en la próxima temporada.
Su compatibilidad con la celulosa y su característica de retardador de fuego convierten al sulfamato de amonio en un agente para obtener telas y papel resistentes al fuego.
Se emplea al 10% del peso de la tela, cuya apariencia y sensación al tacto permanecen inalteradas. La tela cuando esté en uso debe ser lavada al seco, nunca lavada con agua para no disolver al sulfamato.
Es útil especialmente en cortinas de teatros o lugares similares.

Se emplea como catalizador en algunas reacciones químicas, como en la preparación de resinas urea-formaldehido. También es útil como bactericida y estabilizador del cloro en piscinas y como blanqueador de pulpa de madera en las fábricas de pulpa y papel.
- U.S. National Library of Medicine. (2019). Sulfamic acid. Recuperado de pubchem.ncbi.nlm.nih.gov
- Williams, D.L.H. (2004) Nitrosation at nitrogen centres. In Nitrosation Reactions and the Chemistry of Nitric Oxide. Chapter 2. Recuperado de sciencedirect.com
- Clapp, Leallyn B. (1943). Sulfamic acid and its uses. Chem. Educ. 1943, 20, 4, 189. Recuperado de pubs.acs.org
- McDonald, James. (2003). Sulfamic acid. Recuperado de veoliawatertech.com
- Sastri, V.S. (2010). Management and Control of Corrosion. In Shreir’s Corrosion. Recuperado de sciencedirect.com
- Pratima Bajpai. (2018). Miscellaneous Topics. In Biermann’s Handbook of Pulp and Paper. Third Edition. Recuperado de sciencedirect.com
