Geometría molecular: concepto, tipos y ejemplos
La geometría molecular o estructura molecular es la distribución espacial de los átomos alrededor de un átomo central. Los átomos representan regiones donde existe una alta densidad electrónica, y se consideran por tanto grupos electrónicos, sin importar los enlaces que formen (simples, dobles o triples).
La geometría molecular de un elemento puede caracterizar algunas de sus propiedades físicas o químicas (punto de ebullición, viscosidad, densidad, etc.). Por ejemplo, la estructura molecular del agua determina su solubilidad.
Este concepto nace de la combinación y los datos experimentales de dos teorías: la del enlace de valencia (TEV) y la de repulsión de los pares electrónicos de la capa de valencia (RPECV). Mientras que la primera define los enlaces y sus ángulos, la segunda establece la geometría y, por consiguiente, la estructura molecular.
¿Qué formas geométricas son capaces de adoptar las moléculas? Las dos teorías anteriores aportan las respuestas. De acuerdo a la RPECV, los átomos y pares de electrones libres deben disponerse en el espacio de tal manera que disminuyan al máximo la repulsión electrostática entre ellos.
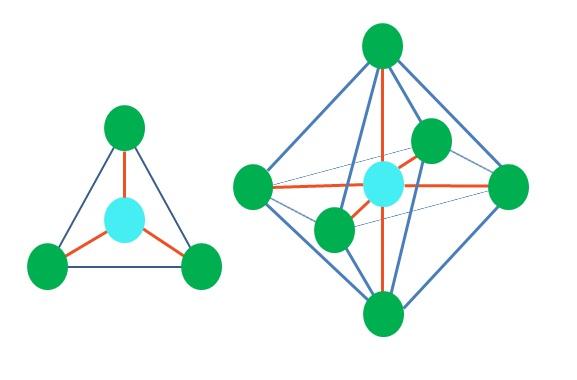
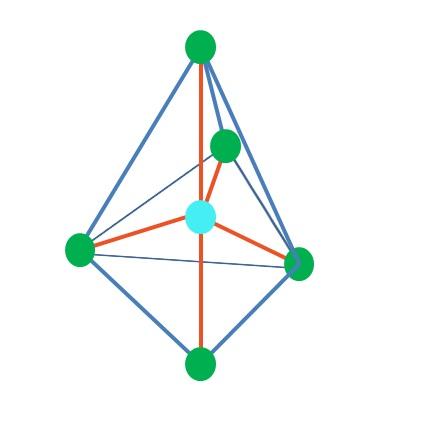
Entonces, las formas geométricas no son arbitrarias, sino que buscan el diseño más estable. Por ejemplo, en la imagen superior puede apreciarse a la izquierda un triángulo, y a la derecha un octaedro. Los puntos verdes representan los átomos y las franjas anaranjadas los enlaces.
En el triángulo, los tres puntos verdes se orientan en una separación de 120º. Este ángulo, que es igual al del enlace, permite que los átomos se repelan entre sí lo menor posible. Por lo tanto, una molécula con un átomo central unido a otros tres adoptará una geometría plano trigonal.
Sin embargo, la RPECV predice que un par de electrones libre en el átomo central distorsionará la geometría. Para el caso del plano trigonal, este par empujará hacia abajo los tres puntos verdes, dando como consecuencia una geometría pirámide trigonal.
Lo mismo también puede ocurrir con el octaedro de la imagen. En él todos los átomos se encuentran separados en la forma más estable posible.
Índice del artículo
- 1 ¿Cómo saber con antelación la geometría molecular de un átomo X?
- 2 Tipos de geometría molecular
- 3 Ejemplos de geometría molecular
- 4 Referencias
Para ello, es necesario considerar también los pares de electrones libres como grupos electrónicos. Estos, juntos a los átomos, definirán lo que se conoce como la geometría electrónica, la cual es compañera inseparable de la geometría molecular.
A partir de la geometría electrónica, y habiendo detectado mediante la estructura de Lewis los pares de electrones libres, se puede establecer cuál será la geometría molecular. La sumatoria de todas las geometrías moleculares brindará un bosquejo de la estructura global.
Como se aprecia en la imagen principal, la geometría molecular depende de cuántos átomos rodean al átomo central. Sin embargo, si están presentes un par de electrones sin compartir, éste modificará la geometría debido a que ocupa mucho volumen. Por lo tanto, ejerce un efecto estérico.
De acuerdo a esto, la geometría puede presentar una serie de formas características para muchas moléculas. Y es aquí donde surgen los diferentes tipos de geometría molecular o estructura molecular.
¿Cuándo la geometría es igual a la estructura? Ambas denotan lo mismo únicamente en los casos donde la estructura no tenga más de un tipo de geometría; de lo contrario, deben considerarse todos los tipos presentes y darle a la estructura un nombre global (lineal, ramificada, globular, plana, etc.).
Las geometrías son especialmente útiles para explicar la estructura de un sólido a partir de sus unidades estructurales.
Todos los enlaces covalentes son direccionales, por lo que el enlace A-B es lineal. Pero, ¿será lineal la molécula AB2? En caso afirmativo, la geometría se representa sencillamente como: B-A-B. Los dos átomos B están separados por un ángulo de 180º, y según la TEV, A debe tener orbitales híbridos sp.
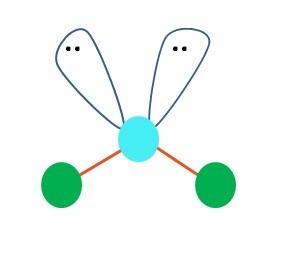
Se puede suponer en primera instancia una geometría lineal para la molécula AB2; sin embargo, es primordial dibujar la estructura de Lewis antes de llegar a una conclusión. Dibujada la estructura de Lewis, se puede identificar el número de pares de electrones sin compartir (:) sobre el átomo de A.
Cuando esto es así, encima de A los pares de electrones empujan los dos átomos de B hacia abajo, cambiando sus ángulos. Como resultado, la molécula lineal B-A-B termina convirtiéndose en una V, un boomerang o en una geometría angular (imagen superior)
La molécula del agua, H-O-H, es el ejemplo ideal para este tipo de geometría. En el átomo de oxígeno hay dos pares de electrones sin compartir los cuales se orientan en un ángulo aproximado de 109º.
¿Por qué este ángulo? Porque la geometría electrónica es tetraédrica, la cual posee cuatro vértices: dos para los átomos de H, y dos para los electrones. En la imagen superior nótese que los puntos verdes y los dos “lóbulos con ojos” dibujan un tetraedro con el punto azulado en su centro.
Si el O no tuviera pares de electrones libre, el agua formaría una molécula lineal, su polaridad disminuiría y los océanos, mares, lagos, etc., probablemente no existirían tal como se conocen.
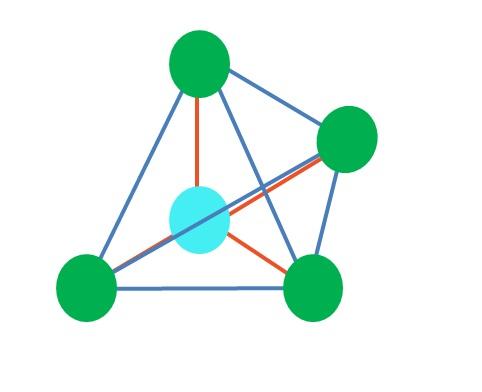
La imagen superior representa la geometría tetraédrica. Para la molécula del agua, su geometría electrónica es tetraédrica, pero al eliminar los pares libres de electrones puede notarse que se transforma en una geometría angular. Esto también se observa sencillamente al eliminar dos puntos verdes; los dos restantes dibujarán la V con el punto azul.
¿Y si en lugar de dos pares de electrones libres hubiera solo uno? Entonces quedaría un plano trigonal (imagen principal). Sin embargo, al eliminar un grupo electrónico, no se evita el efecto estérico que produce el par de electrones libres. Por lo tanto, éste distorsiona el plano trigonal a una pirámide de base triangular:
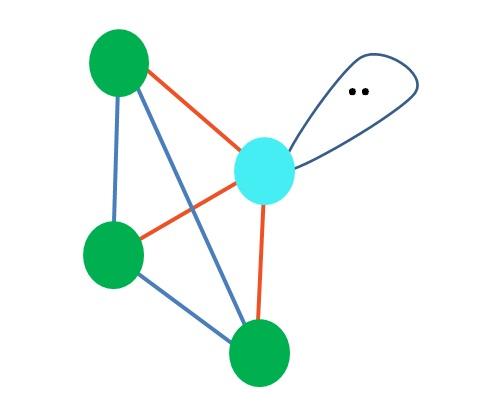
Aunque la geometría molecular pirámide trigonal y tetraédrica sean distintas, la geometría electrónica es la misma: tetraédrica. ¿Entonces la pirámide trigonal no cuenta como geometría electrónica?
La respuesta es no, puesto que es producto de la distorsión provocada por el “lóbulo con ojos” y su efecto estérico, y dicha geometría no toma en cuenta distorsiones posteriores.
Por esta razón, siempre es importante determinar primero la geometría electrónica con ayuda de las estructuras de Lewis antes de definir la geometría molecular. La molécula de amoníaco, NH3, es un ejemplo de geometría molecular pirámide trigonal, pero con geometría electrónica tetraédrica.
Hasta ahora, a excepción de la geometría lineal, en la tetraédrica, la angular y la pirámide trigonal sus átomos centrales tienen hibridación sp3, según la TEV. Esto quiere decir que si se determinara experimentalmente sus ángulos de enlaces, éstos deberían ser alrededor de 109º.
A partir de la geometría dipiramidal trigonal, son cinco los grupos electrónicos entorno al átomo central. En la imagen superior se puede apreciar con los cinco puntos verdes; tres en la base triangular, y dos en posiciones axiales, los cuales son los vértices superior e inferior de la pirámide.
¿Qué hibridación tiene entonces el punto azul? Necesita de cinco orbitales híbridos para formar los enlaces simples (de color anaranjado). Esto lo logra a través de los cinco orbitales sp3d (producto de la mezcla de un orbital s, tres p y un d).
Al considerar cinco grupos electrónicos, la geometría es la ya expuesta, pero al haber pares de electrones sin compartir, ésta nuevamente sufre distorsiones que generan otras geometrías. Asimismo, surge el siguiente interrogante: ¿dichos pares pueden ocupar cualquier posición de la pirámide? Estas son: la axial o la ecuatorial.
Posiciones axial y ecuatorial
Los puntos verdes que componen la base triangular están en posiciones ecuatoriales, mientras que los dos en los extremos superiores e inferiores, en posiciones axiales. ¿Dónde preferencialmente se ubicará el par de electrones sin compartir? En aquella posición que disminuya al máximo la repulsión electrostática y el efecto estérico.
En posición axial el par de electrones haría “presión” perpendicularmente (90º) sobre la base triangular, mientras que si estuviera en posición ecuatorial, los dos restantes grupos electrónicos de la base estarían separados 120º y presionaría los dos extremos a 90º (en lugar de tres, como ocurre con la base).
Por lo tanto, el átomo central buscará orientar sus pares libres de electrones en las posiciones ecuatoriales para generar geometrías moleculares más estables.
Oscilante y forma de T
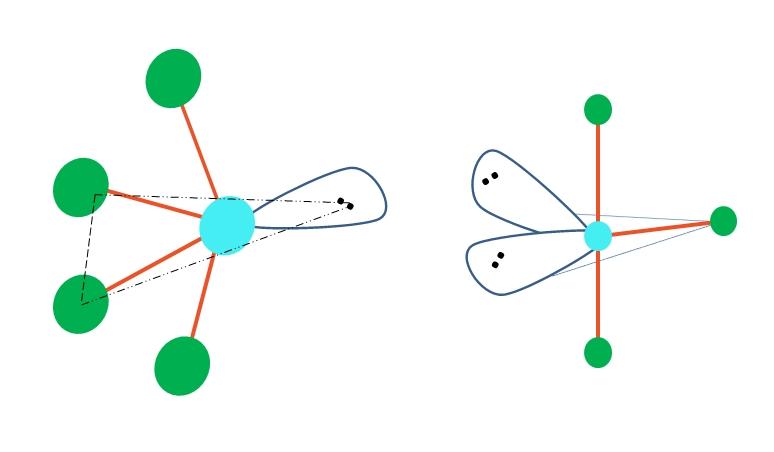
Si en la geometría bipirámide trigonal se sustituyera uno o más de sus átomos por pares libres de electrones, se tendría también distintas geometrías moleculares.
A la izquierda de la imagen superior, la geometría cambia a la forma oscilante. En ella, el par libre de electrones empuja hacia una misma dirección el resto de los cuatro átomos, doblando sus enlaces hacia la izquierda. Nótese que este par y dos de los átomos yacen en el mismo plano triangular de la bipirámide original.
Y a la derecha de la imagen, la geometría con forma de T. Esta geometría molecular es el resultado de sustituir dos átomos por dos pares de electrones, trayendo como consecuencia que los tres átomos restantes se alineen en un mismo plano que dibuja exactamente una letra T.
Entonces, para una molécula del tipo AB5, ésta adopta la geometría bipirámide trigonal. No obstante, AB4, con la misma geometría electrónica, adoptará la geometría oscilante; y AB3, la geometría con forma de T. En todas ellas A tendrá (generalmente) hibridación sp3d.
Para determinar la geometría molecular es necesario dibujar la estructura de Lewis y por tanto su geometría electrónica. Si esta es bipirámide trigonal, se descartará entonces los pares libres de electrones, pero no sus efectos estéricos sobre el resto de los átomos. Así, se puede discernir perfectamente entre las tres geometrías moleculares posibles.
A la derecha de la imagen principal se representa la geometría molecular octaédrica. Este tipo de geometría corresponde a los compuestos AB6. AB4 forman la base cuadrada, mientras que los dos B restante se posicionan en posiciones axiales. Así, se forman varios triángulos equiláteros, los cuales son las caras del octaedro.
Aquí, nuevamente, puede haber (como en todas las geometrías electrónicas) pares de electrones libres, y por lo tanto, derivan de este hecho otras geometrías moleculares. Por ejemplo, AB5 con geometría electrónica octaédrica consiste de una pirámide con base cuadrada, y AB4 de un plano cuadrado:
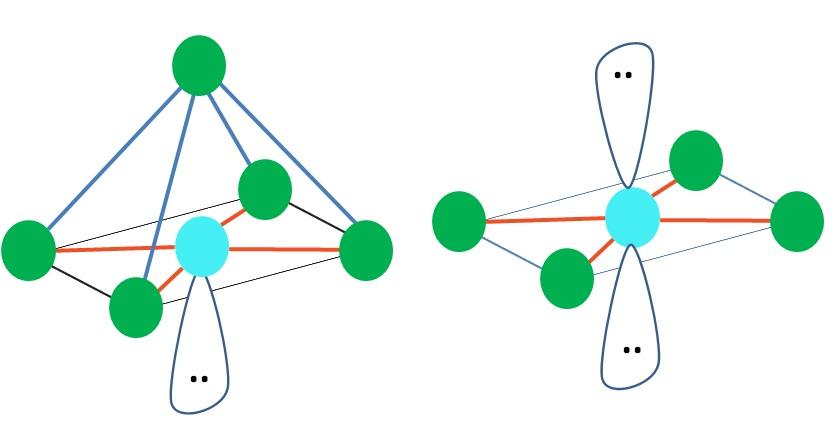
Para el caso de la geometría electrónica octaédrica, estas dos geometrías moleculares son las más estables en términos de repulsión electrostática. En la geometría plano cuadrado los dos pares de electrones se encuentran separados 180º.
¿Cuál es la hibridación para el átomo A en dichas geometrías (o estructuras, si es la única)? Nuevamente, la TEV establece que es sp3d2, seis orbitales híbridos, los cuales le permite a A orientar los grupos electrónicos en los vértices de un octaedro.
Modificando las bases de las pirámides mencionadas hasta ahora, pueden obtenerse algunas geometrías moleculares más complejas. Por ejemplo, la bipirámide pentagonal tiene por base un pentágono y los compuestos que la forman tienen fórmula general AB7.
Al igual que las otras geometrías moleculares, sustituyendo los átomos de B por pares libres de electrones distorsionará la geometría a otras formas.
Asimismo, los compuestos AB8 pueden adoptar geometrías como la de antiprisma cuadrado. Algunas geometrías pueden llegar a ser muy complicadas, en especial para las fórmulas AB7 en adelante (hasta AB12).
A continuación se mencionará una serie de compuestos para cada una de las principales geometrías moleculares. A manera de ejercicio, se podría dibujar las estructuras de Lewis para todos los ejemplos y certificar si, dada la geometría electrónica, se obtiene las geometrías moleculares tal como se enlistan abajo.
-Etileno, H2C≡CH2
-Cloruro de berilio, BeCl2 (Cl-Be-Cl)
-Dióxido de carbono, CO2 (O=C=O)
-Nitrógeno, N2 (N≡N)
-Dibromuro de mercurio, HgBr2 (Br-Hg-Br)
-Anión triyoduro, I3– (I-I-I)
-Ácido cianhídrico, HCN (H-N≡C)
Sus ángulos deben ser 180º, y tener por tanto hibridación sp.
–El agua
-Dióxido de azufre, SO2
-Dióxido de nitrógeno, NO2
-Ozono, O3
-Anión amiduro, NH2–
-Trifluoruro de bromo, BF3
-Tricloruro de aluminio, AlCl3
-Anión nitrato, NO3–
-Anión carbonato, CO32–
-Gas metano, CH4
-Tetracloruro de carbono, CCl4
-Catión amonio, NH4+
-Anión sulfato, SO42-
-Amoníaco, NH3
-Cation hidronio, H3O+
-Pentafluoruro de fósforo, PF5
-Pentacloruro de antimonio, SbF5
Tetrafluoruro de azufre, SF4
-Tricloruro de yodo, ICl3
-Trifluoruro de cloro, ClF3 (ambos compuestos son conocidos como interhalógenos)
-Hexafluoruro de azufre, SF6
-Hexafluoruro de selenio, SeF6
-Hexafluorofosfato, PF6–
Para culminar, la geometría molecular es la que explica las observaciones de las propiedades químicas o físicas de la materia. Sin embargo, se orienta de acuerdo a la geometría electrónica, de manera que esta última debe determinarse siempre antes que la primera.
- Whitten, Davis, Peck & Stanley. Química. (8va ed.). CENGAGE Learning, p 194-198.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición., pág. 23, 24, 80, 169). Mc Graw Hill.
- Mark E. Tuckerman. (2011). Molecular geometry and the VSEPR theory. Recuperado de: nyu.edu
- Virtual Chembook, Charles E. Ophardt. (2003). Introduction to Molecular Geometry. Recuperado de: chemistry.elmhurst.edu
- Chemistry LibreTexts. (08 de septiembre de 2016). Geometry of Molecules. Recuperado de: chem.libretexts.org
