Solución hipotónica: componentes, preparación, ejemplos
Una solución hipotónica es aquella que presenta una concentración de soluto menor respecto a una solución separada o aislada por una barrea semipermeable. Esta barrera permite que el solvente la traspase, agua en el caso de los sistemas biológicos, pero no todas las partículas de soluto.
Los líquidos corporales de los vertebrados intracelulares y extracelulares tienen una osmolaridad de alrededor de 300 mOsm/L. Mientras se considera que un líquido hipotónico tiene una osmolaridad menor a 280 mOsm/L. Por lo que una solución de esta osmolaridad es hipotónica con relación al medio celular.
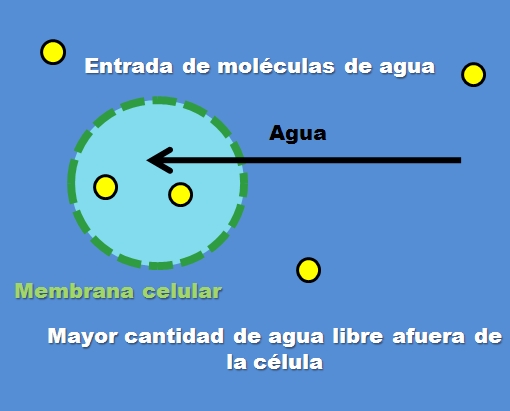
Un ejemplo de una solución hipotónica es la del cloruro de sodio al 0,45%. Pero, ¿cómo se comporta la célula o un compartimiento frente a este tipo de solución? La imagen superior responde a esta pregunta.
La concentración de las partículas de soluto (puntos amarillos) es mayor dentro de la célula que afuera. Al haber menos soluto entorno a la célula, hay mayor cantidad de moléculas de agua libres, por lo que se representa con un color azul más intenso en comparación al interior de la célula.
El agua fluye de afuera hacia adentro mediante la ósmosis para nivelar las concentraciones. Como resultado, la célula se expande o hincha al absorber agua que traspasa su membrana celular.
Índice del artículo
- 1 Componentes de las soluciones hipotónicas
- 2 Preparación de una solución hipotónica
- 3 Ejemplos de soluciones hipotónicas
- 4 Referencias
Las soluciones hipotónicas constan de un solvente que, a menos que se indique lo contrario, consiste de agua, y de solutos disueltos en ella tales como sales, azúcares, etc., en forma pura o mezclados. Pero esta solución no tendrá tonicidad alguna si no hay de por medio una barrera semipermeable, que viene a ser la membrana celular.
Tiene que haber pocas sales disueltas para que su concentración sea pequeña, mientras la “concentración” del agua sea elevada. Al haber más agua libre afuera de la célula, es decir, que no esté solvatando o hidratando partículas de soluto, mayor será su presión sobre la membrana celular y más tenderá a cruzarla para diluir el líquido intracelular.
Para la preparación de estas soluciones se sigue el mismo protocolo que el seguido para otras soluciones. Se hacen los cálculos apropiados de la masa de los solutos. Luego estos se pesan, se disuelven en agua y se llevan a un matraz aforado al volumen que le corresponde.
La solución hipotónica tiene una osmolaridad baja, generalmente menor a 280 mOsm/L. Así que al preparar una solución hipotónica debemos calcular su osmolaridad de tal modo que su valor sea menor a 280 mOsm/L. La osmolaridad podemos calcularla con la siguiente ecuación:
Osmolaridad = m · v · g
Donde m es la molaridad del soluto, y v el número de partículas en que se disocia un compuesto en solución. Las sustancias no electrolíticas no se disocian, por lo que el valor de v es igual a 1. Este es el caso de la glucosa y otros azúcares.
Mientras g es el coeficiente osmótico. Este es un factor de corrección para la interacción de las partículas cargadas eléctricamente (iones) en solución. Para las soluciones diluidas y sustancias no disociables, por ejemplo y nuevamente la glucosa, se toma un valor de g igual a 1. Se dice entonces que la molaridad es idéntica a su osmolaridad.
Preparar una solución de cloruro de sodio (NaCl) al 0,5 % (p/v) comprobando si es o no una solución hipotónica. Peso molecular NaCl = 58,5 g/mol.
Se lleva la solución de NaCl al 0,5 % a gramo por litro:
NaCl en g/l = (0,5 g ÷100 mL) · 1.000 mL
= 5 g/L
Y procedemos a calcular su molaridad para después determinar su osmolaridad:
Molaridad = masa (g/L) ÷ peso molecular (g/mol)
= 5 g/L ÷ 58,5 g/mol
= 0,085 moles/L
El NaCl se disocia en dos partículas: Na+ (catión) y Cl– (anión). Por lo que el valor de v = 2. Asimismo, por ser una solución diluida de NaCl al 0,5 %, se puede asumir que el valor de g (coeficiente osmótico) es de 1. Tenemos entonces:
Osmolaridad (NaCl) = molaridad · v · g
= 0,085 M · 2 · 1
= 0,170 Osm/L o 170 mOsm/L
Esta es una solución hipotónica, ya que su osmolaridad es mucho menor que la osmolaridad de referencia para los líquidos corporales que es la osmolaridad plasmática cuyo valor está alrededor de 300 mOsm/L.
Preparar una solución de una mezcla de cloruro de calcio (CaCl2) al 0,055 % (p/v) y glucosa (C6H12O6) al 4 % (p/v). Pesos moleculares: CaCl2 = 111 g/mol y C6H12O6 = 180 g/mol.
Calculamos la molaridad teniendo las concentraciones de los respectivos solutos en 0,55 g/L y 40 g/L:
Molaridad (CaCl2) = 0,55 g/L ÷ 111 g/mol
= 4,95 · 10-3 M
= 4,95 mM
Molaridad (C6H12O6) = 40 g/L ÷ 180 g/mol
= 0,222 M
= 222 mM
Y de igual modo calculamos las osmolaridades, sabiendo que el CaCl2 se disocia en tres iones, dos Cl– y un Ca2+, y asumiendo que se tratan de soluciones muy diluidas, por lo que el valor de v es 1. Tenemos pues:
Osmolaridad (CaCl2) = 4,95 mM · 3 · 1
= 14,85 mOsm/L
Osmolaridad de (C6H12O6) = 222 mM · 1 · 1
= 222 mOsm/L
Finalmente, la osmolaridad total de la solución viene a ser la sumatoria de las osmolaridades individuales; es decir, de las del NaCl y la glucosa. Esta es por lo tanto:
Osmolaridad total de la solución = osmolaridad CaCl2 + osmolaridad C6H12O6
= 222 mOsm/L + 14,85 mOsm/L
= 236,85 mOsm/L
La solución de la mezcla de cloruro de calcio y glucosa es hipotónica, ya que su osmolaridad (236,85 mOsm/L) es mucho menor que la osmolaridad del plasma (300 mOsm/L), la cual es tomada como referencia.
La solución de cloruro de sodio (NaCl) al 0,45 % es administrada en forma intravenosa a pacientes con cetosis diabética que desarrollan una deshidratación en los compartimientos intersticial e intracelular. El agua fluye desde el plasma hacia esos compartimientos.
La solución de Ringer Lactato Nº 19 es otro ejemplo de una solución hipotónica. Su composición es de 0,6 g cloruro de sodio, 0,03 g de cloruro de potasio, 0,02 g de cloruro de calcio, 0,31 g de lactato de sodio, y 100 mL de agua destilada. Es una solución utilizada para la rehidratación de pacientes y es ligeramente hipotónica (274 mosm/L).
- De Lehr Spilva, A. y Muktans, Y. (1999). Guía de las Especialidades Farmacéuticas en Venezuela. XXXVª Edición. Global Ediciones.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Wikipedia. (2020). Tonicity. Recuperado de: en.wikipedia.org
- Union Media LLC. (2020). Isotonic, Hypotonic, and Hypertonic Solutions. Recuperado de: uniontestprep.com
- Lodish H, Berk A, Zipursky SL, et al. (2000). Section 15.8Osmosis, Water Channels, and the Regulation of Cell Volume. NCBI Bookshelf. Recuperado de: ncbi.nlm.nih.gov
- John Brennan. (13 de marzo de 2018). How to Calculate Isotonicity. Recuperado de: sciencing.com
