Leucina: características, estructura, funciones, biosíntesis
La leucina es uno de los 22 aminoácidos que constituyen a las proteínas de los organismos vivos. Esta pertenece a uno de los 9 aminoácidos esenciales que no son sintetizados por el cuerpo y deben ser consumidos con los alimentos ingeridos en la dieta.
La leucina fue descrita por primera vez en 1818 por el farmacéutico y químico francés J. L. Proust, quien la denominó “óxido-caseoso”. Más tarde, Erlenmeyer y Kunlin, la prepararon a partir del ácido α-benzoilamido-β-isopropilacrílico, cuya fórmula molecular es C6H13NO2.
La leucina fue clave durante el descubrimiento del sentido de la traducción de las proteínas, ya que su estructura hidrofóbica le permitió al bioquímico Howard Dintzis marcar radiactivamente el hidrógeno del carbono 3 y observar el sentido en el cual se incorporan los aminoácidos en la síntesis peptídica de la hemoglobina.
Las proteínas conocidas como “cremalleras” o “cierres” de leucina son, junto con los “dedos de zinc”, los factores de transcripción más importantes de los organismos eucariotas. Las cremalleras de leucina se caracterizan por sus interacciones hidrofóbicas con el ADN.
Generalmente, las proteínas ricas en leucina o constituidas por aminoácidos ramificados no son metabolizadas en el hígado, en su lugar, van directamente a los músculos en donde son empleadas rápidamente para la síntesis de proteínas y la obtención de energía.
La leucina es un aminoácido de cadena ramificada necesario para la biosíntesis de las proteínas y los aminoácidos de la leche, que son sintetizados en las glándulas mamarias. Se pueden encontrar grandes cantidades de este aminoácido en forma libre dentro de la leche materna.
Entre todos los aminoácidos que componen a las proteínas, la leucina y la arginina son lo más abundantes y ambos han sido detectados en las proteínas de todos los reinos que componen el árbol de la vida.
Índice del artículo
- 1 Características
- 2 Estructura
- 3 Funciones
- 4 Biosíntesis
- 5 Degradación
- 6 Alimentos ricos en leucina
- 7 Beneficios de su ingesta
- 8 Trastornos por deficiencia
- 9 Referencias
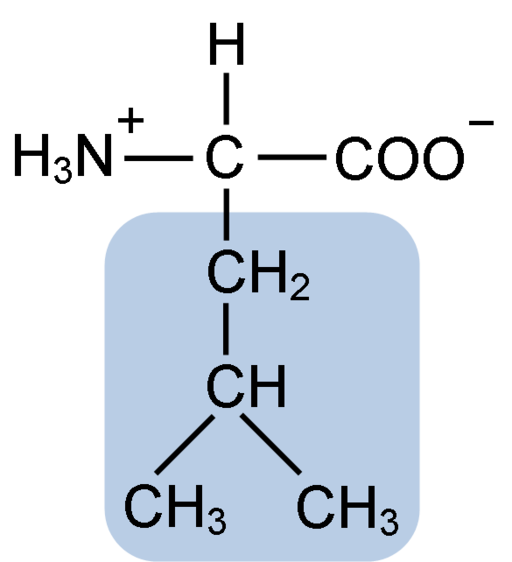
La leucina es conocida como el aminoácido esencial de cadena ramificada, este comparte la estructura típica con los demás aminoácidos. Sin embargo, se distingue porque su cadena lateral o grupo R posee dos carbonos unidos linealmente, y el último de ellos está unido a un átomo de hidrógeno y a dos grupos metilo.
Pertenece al grupo de los aminoácidos polares sin carga, los sustituyentes o grupos R de estos aminoácidos son de carácter hidrofóbico y no polares. Estos aminoácidos son los principales responsables de las interacciones hidrofóbicas intra- e inter-proteicas y tienden a estabilizar la estructura de las proteínas.
Todos los aminoácidos, al poseer un carbono central que es quiral (carbono α), es decir, que posee cuatro sustituyentes diferentes unidos, pueden encontrarse en dos formas diferentes en la naturaleza; así, existen la D- y la L-leucina, esta última típica en las estructuras proteicas.
Ambas formas de cada aminoácido tienen propiedades diferentes, participan en rutas metabólicas distintas e incluso pueden modificar las características de las estructuras de que son parte.
Por ejemplo, la leucina en forma L-leucina tiene un sabor ligeramente amargo, mientras que en su forma D-leucina es muy dulce.
La forma L de cualquier aminoácido es más fácil de metabolizar por el organismo de los mamíferos. La L-leucina es fácilmente degradada y aprovechada para la construcción y la protección de las proteínas.
La leucina se compone de 6 átomos de carbono. El carbono central, común en todos los aminoácidos, está unido a un grupo carboxilo (COOH), a un grupo amino (NH2), a un átomo de hidrógeno (H) y a una cadena lateral o grupo R compuesta por 4 átomos de carbono.
Los átomos de carbono dentro de los aminoácidos pueden ser identificados con letras griegas. La numeración comienza a partir del carbono del ácido carboxílico (COOH), mientras que la anotación con el alfabeto griego comienza a partir del carbono central.
La leucina tiene como grupo sustituyente en su cadena R a un grupo isobutilo o 2-metilpropilo que se produce por la pérdida de un átomo de hidrógeno, con la formación de un radical alquilo; estos grupos aparecen como ramificaciones en la estructura del aminoácido.
La leucina es un aminoácido que puede servir como precursor cetogénico de otros compuestos implicados en el ciclo del ácido cítrico. Este aminoácido representa una importante fuente para la síntesis del acetil-CoA o del acetoacetil-CoA, que forman parte de las rutas de formación de los cuerpos cetónicos en las células hepáticas.
Se sabe que la leucina es indispensable en las vías de señalización de la insulina, que participa en el inicio de la síntesis de proteínas y que evita la pérdida de proteínas por degradación.
Habitualmente, las estructuras internas de las proteínas están compuestas por aminoácidos hidrofóbicos como la leucina, la valina, la isoleucina y la metionina. Tales estructuras suelen ser conservadas para enzimas comunes entre los organismos vivos, como en el caso del Citocromo C.
La leucina puede activar rutas metabólicas en las células de las glándulas mamarias para estimular la síntesis de lactosa, de lípidos y de proteínas que cumplen funciones como moléculas señalizadoras en la regulación de la homeostasis energética de las crías en los mamíferos.
Los dominios ricos en leucina son parte imprescindible de unas proteínas específicas de unión a ADN, que generalmente son dímeros estructurales en forma súper enrollada y que se conocen como “proteínas con cremalleras de leucina”.
Estas proteínas poseen como característica distintiva un patrón regular de leucinas repetidas junto con otros aminoácidos hidrofóbicos que se encargan de regular las uniones de los factores de transcripción al ADN y entre distintos factores de transcripción.
Las proteínas con cremallera de leucinas pueden formar homo- o heterodímeros que les permiten enlazarse con regiones específicas de los factores de transcripción para regular su emparejamiento y su interacción con las moléculas de ADN que estos regulan.
Todos los aminoácidos de cadena ramificada, incluyendo a la leucina, son sintetizados principalmente en plantas y en bacterias. En las plantas en floración hay un aumento significativo de la producción de leucina, ya que es un importante precursor para todos los compuestos responsables del aroma de las flores y los frutos.
Uno de los factores a los que se atribuye la gran abundancia de la leucina en los distintos péptidos bacterianos es que 6 codones diferentes del código genético codifican para leucina (UUA-UUG-CUU-CUC-CUA-CUG), lo mismo también es cierto para la arginina.
La leucina es sintetizada en las bacterias a partir de una ruta de cinco pasos que emplea como punto de partida un cetoácido relacionado con la valina.
Este proceso es regulado de alostéricamente, de modo que cuando existe un exceso de leucina en el interior celular, esta inhibe a las enzimas que participa en la ruta y detiene la síntesis.
La biosíntesis de la leucina en las bacterias comienza con la conversión de un derivado cetoácido de la valina, el 3-metil-2-oxobutanoato en (2S)-2-isopropilmalato, gracias a la acción de la enzima 2-isopropilmalto sintasa, que utiliza acetil-Coa y agua para dicho fin.
El (2S)-2-isopropilmalato pierde una molécula de agua y es transformado en 2-isopropilmaleato por la 3-isopropilmalato deshidratasa. Posteriormente, la misma enzima añade otra molécula de agua y transforma el 2-isopropilmaleato en (2R-3S)-3-isopropilmalato.
Este último compuesto es sometido a una reacción de oxidorreducción que amerita la participación de una molécula de NAD+, con lo que se produce el (2S)-2-isopropil-3-oxosuccinato, lo que es posible con la participación de la enzima 3-isopropilmalato deshidrogenasa.
El (2S)-2-isopropil-3-oxosuccinato pierde un átomo de carbono en forma de CO2 espontáneamente, generando el 4-metil-2-oxopentanoato que, por acción de una transaminasa de aminoácidos de cadena ramificada (leucina transaminasa, específicamente) y con la liberación concomitante de L-glutamato y 2-oxoglutarato, produce L-leucina.
El principal papel de la leucina es actuar como señalizador que le indica a la célula que existen aminoácidos y energía suficientes para comenzar la síntesis de las proteínas musculares.
La degradación de aminoácidos de cadena ramificada como la leucina comienza con una transaminación. Este y los dos pasos enzimáticos subsecuentes son catalizados por las tres mismas enzimas en el caso de la leucina, la isoleucina y la valina.
La transaminación de los tres aminoácidos produce los derivado α-cetoacídicos de estos, que son sometidos a una descarboxilación oxidativa para producir tioésteres de acil-CoA que son α,β-deshidrogenados para rendir tioésteres de acil-CoA α,β-insaturados.
Durante el catabolismo de la leucina, el tioéster de acil-CoA α,β-insaturado correspondiente es empleado para producir acetoacetato (ácido acetoacético) y acetil-CoA a través de una vía que involucra el metabolito 3-hidroxi-3-metilglutaril-CoA (HMG-CoA), que es intermediario en la biosíntesis del colesterol y otros isoprenoides.
A partir de la formación del tioéster de acil-CoA α,β-insaturado que deriva de la leucina las rutas catabólicas de este aminoácido y de la valina y la isoleucina divergen considerablemente.
El tioéster de acil-CoA α,β-insaturado de la leucina es procesado aguas abajo por tres enzimas diferentes conocidas como (1) 3-metilcrotonil-CoA carboxilasa, (2) 3-metilglutaconil-CoA hidratasa y (3) 3-hidroxi-3-metilglutaril-CoA liasa.
En las bacterias, estas enzimas se encargan de la conversión del 3-metilcrotonil-CoA (derivado de la leucina) en 3-metilglutaconil-CoA, en 3-hidroxi-3-metilglutaril-CoA y en acetoacetato y acetil-CoA, respectivamente.
La leucina que se encuentra disponible en la sangre es aprovechada para la síntesis de proteínas musculares/miofibrilares (MPS). Esta actúa como un factor activador de este proceso. También, interactúa directamente con la insulina, influyendo en el suministro de la
El consumo de proteínas ricas en aminoácidos es indispensable para la fisiología celular de los organismos vivos y la leucina no es una excepción entre los aminoácidos esenciales.
Las proteínas obtenidas a partir del suero lácteo se consideran de las más ricas en residuos de L-leucina. No obstante, todos los alimentos con altos contenidos proteicos como el pescado, el pollo, el huevo y las carnes rojas aportan grandes cantidades de leucina para el cuerpo.
El maíz en grano es deficiente en los aminoácidos lisina y triptófano, tiene estructuras terciarias muy rígidas para la digestión y tiene poco valor desde el punto de vista nutricional, empero, posee altos niveles de leucina e isoleucina.
Los frutos de las plantas leguminosas son ricos en casi todos los aminoácidos esenciales: lisina, treonina, isoleucina, leucina, fenilalanina y valina, pero tienen escaso contenido de metionina y cisteína.
La leucina es extraída, purificada y concentrada en comprimidos como suplementos alimenticios para los atletas de alta competencia y es comercializada como fármaco. La fuente principal para el aislamiento de este aminoácido corresponde a las harinas desgrasadas de soja.
Existe un suplemento alimenticio empleado por los atletas para la regeneración muscular que se conoce como BCAA (del inglés “Branched Chain Amino Acids”). Este aporta altas concentraciones de los aminoácidos de cadena ramificada: leucina, valina e isoleucina.
Los alimentos ricos en leucina ayudan a controlar la obesidad y otras enfermedades metabólicas. Muchos nutricionistas señalan que los alimentos ricos en leucina y los suplementos alimenticios basado en este aminoácido contribuyen en la regulación del apetito y la ansiedad en los adultos.
Todas las proteínas ricas en leucina estimulan la síntesis proteica muscular; se ha demostrado que un aumento de la proporción de leucina ingerida respecto a los otros aminoácidos esenciales puede revertir la atenuación de la síntesis proteica en la musculatura de los pacientes ancianos.
Incluso, personas con trastornos maculares graves que se encuentran paralizados pueden detener la pérdida de masa y fuerza muscular con la correcta suplementación oral de leucina, además de aplicar ejercicios sistémicos de resistencia muscular.
La leucina, la valina y la isoleucina son esenciales componentes de la masa que conforma el músculo esquelético de los animales vertebrados, por lo que su presencia es vital para la síntesis de proteínas nuevas o para la reparación de las preexistentes.
Las deficiencias o malformaciones del complejo enzimático α-cetoácido deshidrogenasa, que se encarga de metabolizar la leucina, la valina y la isoleucina en los seres humanos, puede causar trastornos mentales severos.
Además, existe una condición patológica relacionada con el metabolismo de estos aminoácidos de cadena ramificada que se denomina “Enfermedad de la orina con olor a jarabe de arce”.
Hasta la fecha no se ha demostrado la existencia de efectos adversos en el consumo excesivo de leucina. Sin embargo, se recomienda una dosis máxima de 550 mg/kg diarios, puesto que no se han realizado estudios a largo plazo relacionados con la exposición excesiva de los tejidos a dicho aminoácido.
- Álava, M. D. C., Camacho, M. E., & Delgadillo, J. (2012). Salud muscular y prevención de sarcopenia: el efecto de la proteína, leucina y ß-hidroxi-ß-metilbutirato. Revista Metabolismo Óseo y Mineral, 10(2), 98-102.
- Fennema, O. R. (1993). Química de los alimentos (No. 664: 543). Acribia.
- Massey, L. K., Sokatch, J. R., & Conrad, R. S. (1976). Branched-chain amino acid catabolism in bacteria. Bacteriological reviews, 40(1), 42.
- Mathews, C. K., & Ahern, K. G. (2002). Bioquímica. Pearson Education.
- Mero, A. (1999). Leucine supplementation and intensive training. Sports Medicine, 27(6), 347-358.
- Munro, H. N. (Ed.). (2012). Mammalian protein metabolism (Vol. 4). Elsevier
- Nelson, D. L., Lehninger, A. L., & Cox, M. M. (2008). Lehninger principles of biochemistry. Macmillan.
