Ácido selenhídrico (H2Se): estructura, propiedades y usos
El ácido selenhídrico o seleniuro de hidrógeno es un compuesto inorgánico cuya fórmula química es H2Se. Es de naturaleza covalente, y en condiciones ordinarias de temperatura y presión es un gas incoloro; pero con un fuerte olor reconocible a su menor presencia. Químicamente, se trata de un calcogenuro, por lo que el selenio tiene valencia de -2 (Se2-).
De todos los seleniuros, el H2Se es el más tóxico debido a que su molécula es pequeña y su átomo de selenio tiene menor impedimento estérico al momento de reaccionar. Por otro lado, su olor permite que quienes trabajen con él lo detecten en el acto en caso de una fuga fuera de la campana de laboratorio.
El seleniuro de hidrógeno puede sintetizar por la combinación directa de sus dos elementos: hidrógeno molecular, H2, y selenio metálico. Asimismo, puede obtenerse disolviendo compuestos ricos en selenio, como el seleniuro de hierro (II), FeSe, en ácido clorhídrico.
Por otro lado, el ácido selenhídrico se prepara disolviendo el seleniuro de hidrógeno en agua; es decir, el primero está disuelto en el agua, mientras que el segundo consiste en moléculas gaseosas.
Su principal uso es ser una fuente de selenio en síntesis orgánicas e inorgánicas.
Índice del artículo
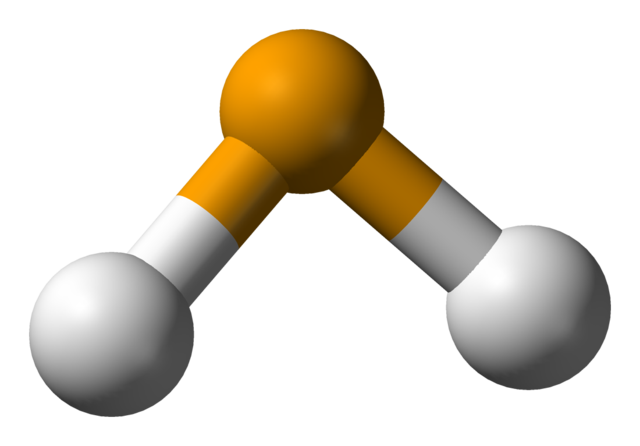
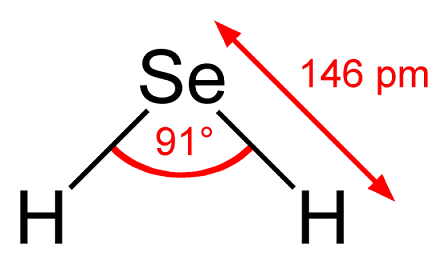
En la imagen superior se observa que la molécula de H2Se es de geometría angular, aunque su ángulo de 91° hace que se parezca más a una L que a una V. En este modelo de esferas y barras, los átomos de hidrógeno y el del selenio son las esferas de color blanco y amarillo, respectivamente.
Esta molécula tal y como se muestra, es la que se halla en fase gaseosa; es decir, para el seleniuro de hidrógeno. Cuando se disuelve en agua, libera un protón y en solución se tiene el par HSe– H3O+; este par de iones viene a el ácido selenhídrico, denotado como H2Se(ac) para diferenciarlo del seleniuro de hidrógeno, H2Se(g).
Por lo tanto, las estructuras entre el H2Se(ac) y H2Se(g) son muy diferentes; el primero está rodeada de una esfera acuosa y presenta cargas iónicas, y el segundo consiste en un aglomerado de moléculas en fase gaseosa.
Las moléculas de H2Se apenas pueden interactuar unas con otras mediante fuerzas muy débiles dipolo-dipolo. El selenio, aunque es menos electronegativo que el azufre concentra mayor densidad electrónicas al “arrebatársela” a los átomos de hidrógeno.
Hidruros de selenio comprimidos
Si las moléculas de H2Se se someten a una extraordinaria presión (cientos de GPa), teóricamente se les obliga a solidificarse mediante la formación de enlaces Se-H-Se; estos son enlaces de tres centros y dos electrones (3c-2e) donde participa el hidrógeno. Por lo tanto, las moléculas empiezan a formar estructuras poliméricas que definen un sólido.
Bajo estas condiciones, se puede enriquecer el sólido con más hidrógeno, lo cual modifica por completo las estructuras resultantes. Además, la composición pasa a ser del tipo HnSe, donde n varía de 3 hasta 6. Así, los hidruros de selenio comprimidos por estas presiones, y en presencia de hidrógeno, tienen fórmulas químicas H3Se a H6Se.
Se estima que estos hidruros de selenio enriquecidos con hidrógeno tengan propiedades superconductoras.
Gas incoloro que a bajas temperaturas huele a rábano putrefacto y a huevos podridos si su concentración aumenta. Su olor es peor y más intenso que el del sulfuro de hidrógeno (que de por sí ya es bastante desagradable). Sin embargo, esto es bueno, ya que ayuda a su fácil detección y disminuye los riesgos de contacto o inhalación prolongados.
Cuando arde, desprende una llama azulada producto de las interacciones electrónicas en los átomos de selenio.
80,98 g/mol.
-41°C.
-66°C.
9,5 atm a 21°C.
3,553 g/L.
3,89.
0,70 g/100 mL. Esto corrobora el hecho de que el átomo de selenio del H2Se no puede formar puentes de hidrógeno apreciables con las moléculas de agua.
-Soluble en CS2, lo cual no es de extrañar por la analogía química entre el selenio y el azufre.
-Soluble en fosgeno (a bajas temperaturas, pues hierve a los 8°C).
Como ya se ha explicado en apartados anteriores, el nombre de este compuesto varía dependiendo de si H2Se está en fase gaseosa o disuelto en agua. Cuando está en agua, se habla del ácido selenhídrico, el cual no es más que un hidrácido en términos inorgánicos. A diferencia de las moléculas gaseosas, su carácter ácido es mayor.
No obstante, ya sea como gas o disuelto en agua, el átomo de selenio mantiene las mismas características electrónicas; por ejemplo, su valencia es -2, a menos que sufra una reacción de oxidación. Esta valencia de -2 es la razón de por qué se llama seleniuro de hidrógeno, ya que el anión seleniuro es el Se2-; el cual, es más reactivo y reductor que el S2-, sulfuro.
Si se emplea la nomenclatura sistemática, se tiene que especificar el número de átomos de hidrógeno en el compuesto. Así, el H2Se se llama: seleniuro de dihidrógeno.
Algunas fuentes se refieren a él como un hidruro. Si realmente lo fuera, el selenio tendría carga positiva +2, y el hidrógeno carga negativa -1: SeH2 (Se2+, H–). El selenio es un átomo más electronegativo que el hidrógeno, y por lo tanto termina “acaparando” la mayor densidad electrónica en la molécula de H2Se.
No obstante, como tal no puede descartarse teóricamente la existencia del hidruro de selenio. De hecho, con la presencia de los aniones H– facilitaría los enlaces Se-H-Se, responsables de las estructuras sólidas formadas a enormes presiones de acuerdo a estudios computacionales.
Aunque parezca contradictorio, pese a la gran toxicidad del H2Se, es producido en el organismo en la ruta metabólica del selenio. Sin embargo, apenas se produce las células lo utilizan como intermediario en las síntesis de selenioproteínas, o termina siendo metilado y excretado; uno de los síntomas de esto es el sabor a ajo en la boca.
El H2Se se utiliza principalmente para adicionar átomos de selenio a estructuras sólidas, como materiales semiconductores; a moléculas orgánicas, como los alquenos y nitrilos para la síntesis de seleniuros orgánicos; o a una disolución para que precipiten seleniuros metálicos.
- Wikipedia. (2018). Hydrogen selenide. Recuperado de: en.wikipedia.org
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Atomistry. (2012). Hydrogen Selenide, H2Se. Recuperado de: selenium.atomistry.com
- Tang Y. & col. (2017). Hydrogen Selenide (H2Se) Dopant Gas for Selenium Implantation. 21st International Conference on Ion Implantation Technology (IIT). Tainan, Taiwan.
- Formulación química. (2018). Seleniuro de hidrógeno. Recuperado de: formulacionquimica.com
- PubChem. (2019). Hydrogen selenide. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Zhang, S. et al. (2015). Phase Diagram and High-Temperature Superconductivity of Compressed Selenium Hydrides. Sci. Rep. 5, 15433; doi: 10.1038/srep15433.
- Acidos.Info. (2019). Ácido selenhídrico: propiedades y aplicaciones de este hidrácido. Recuperado de: acidos.info/selenhidrico
