Teoría del orbital molecular: explicación, enlaces, orbitales y ejemplos
¿En qué consiste la teoría del orbital molecular?
La teoría del orbital molecular (TOM) es un modelo matemático desarrollado para explicar las propiedades fisicoquímicas de las moléculas, tales como la absorción y emisión de radiación, la conductividad eléctrica, así como la naturaleza electrónica de sus enlaces. Esta considera, a diferencia de la teoría del enlace de valencia (TEV), que los electrones se encuentran deslocalizados por toda la molécula, sin localizarse probabilísticamente en los enlaces.
Por lo tanto, la teoría del orbital molecular aplica los mismos principios cuánticos que dictan las funciones de onda para los orbitales atómicos, describiendo así el estado energético de los electrones en los átomos; solo que ahora, aborda los llamados orbitales moleculares, originados a partir de las combinaciones lineales de los orbitales atómicos de los átomos que se enlazan.
La teoría del orbital molecular funciona pues, trabajando con los orbitales moleculares, sus distribuciones electrónicas y espaciales, así como los diagramas de sus respectivas energías, los cuales permiten observar las brechas energéticas que los separan. Sobre todo, explica el paramagnetismo de ciertas sustancias, como el oxígeno molecular en estado líquido (ver arriba).
El O2, descrito por las estructuras de Lewis y la teoría del enlace de valencia, tiene todos sus electrones apareados, por lo que en teoría debería de ser diamagnético. Sin embargo, en la práctica se ha demostrado que es en realidad paramagnético, es decir, que tiene electrones desapareados; específicamente un par de electrones desapareados.
A partir de la construcción del diagrama de los OM (orbitales moleculares) para el O2, una molécula diatómica homonuclear, se podrá ver que efectivamente habrá dos electrones desapareados de alta energía. No solo esto, sino que el espín y la posición de dichos electrones en los OM explican también otros estados electrónicos del O2 (singlete).
Otros de los triunfos más importantes de la teoría del orbital molecular es que ayuda a predecir la posible existencia de moléculas diatómicas, al igual que sus relativas estabilidades. Así, la teoría del orbital molecular acierta en la predicción de moléculas como B2 y Li2, aun cuando solamente puedan detectárseles en la fase de vapor a altas temperaturas. Asimismo, esta teoría rechaza la existencia de las hipotéticas moléculas de He2 o Ne2.
Tipos de enlaces y orbitales moleculares
Así como sucede con la teoría del enlace de valencia, en la teoría del orbital molecular se consideran varios tipos de enlaces dependiendo de la direccionalidad del traslapo de los orbitales atómicos que participan en el enlace químico. Entre los más importantes y presentes en la naturaleza molecular, tenemos los enlaces sigma y pi.
Sigma
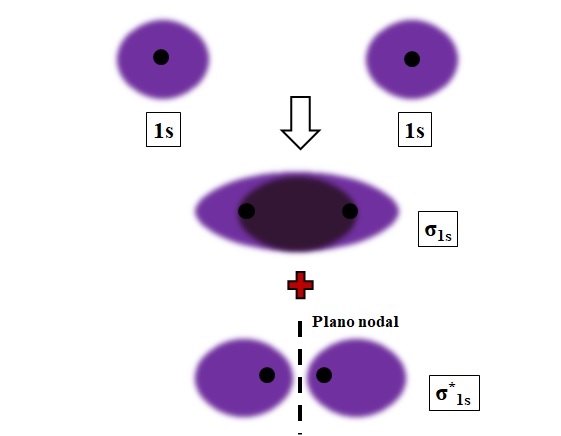
Los enlaces sigma, σ, se establecen cuando los orbitales atómicos se traslapan frontalmente, en relación a un eje internuclear imaginario que conecta los dos núcleos que se aproximan.
Considérese por ejemplo el enlace σ que se forma cuando dos orbitales atómicos 1s, a decir de un átomo de hidrógeno, se acercan a una distancia muy corta (imagen de arriba). Debido a que los orbitales 1s son simétricos, su traslape siempre será frontal; por lo tanto, siempre generarán orbitales moleculares σ1s y σ1s*.
Nótese ahora que el orbital molecular σ1s muestra una densidad electrónica concentrada en el espacio que separa los dos núcleos. Esto quiere decir que en un orbital σ1s la probabilidad de encontrar un electrón es máxima en esta región de la molécula. Los electrones del σ1s se deslocalizan por todo el espacio que abarca el color morado.
En cambio, en el orbital σ1s* tenemos un plano nodal entre los dos núcleos. Esto significa que la probabilidad de encontrar un electrón entre ese espacio es igual a cero. Nótese además que en el orbital σ1s* los electrones describen posiciones en torno a cada uno de los dos núcleos; no alrededor de la molécula como un todo.
Pi
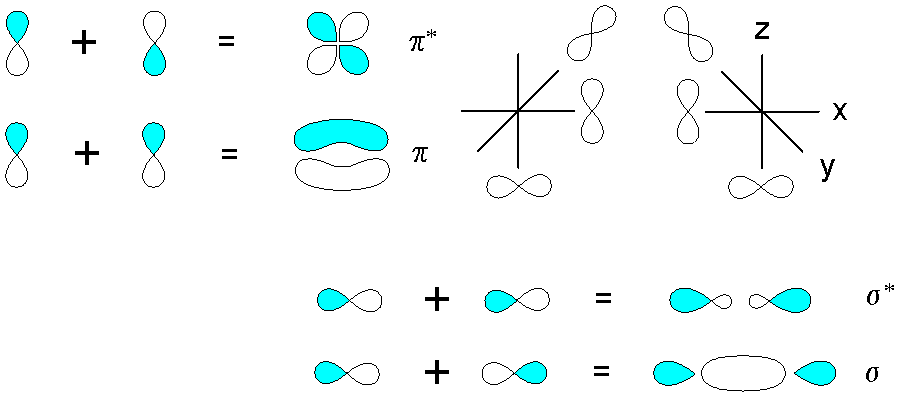
Considérese ahora los enlaces y orbitales moleculares pi o π. Estos ocurren cuando el traslapo de los orbitales sucede en una dirección perpendicular al eje internuclear, el cual es fijado arbitrariamente en cualquiera de los ejes del plano cartesiano. Suponiendo que hablamos de un orbital 2px, el orbital 2py quedará libre para establecer un enlace pi (ver lóbulos de azul y blanco en vertical).
Cuando dos orbitales 2py se traslapan originan dos orbitales moleculares: π2py y π2py*; el primero tiene la mayor densidad electrónica arriba y abajo del eje internuclear, mientras que el segundo se asemeja a una flor de cuatro pétalos, donde la probabilidad de encontrar los electrones es mucho menor.
Por otro lado, los orbitales 2p, a decir 2px, también pueden traslaparse frontalmente para originar un enlace σ y dos orbitales moleculares σ2px y σ2px*. Al igual que en los casos de σ1s y σ1s*, el orbital σ2px muestra una mayor densidad electrónica entre los dos núcleos; cosa que es contraria en σ2px*, donde los electrones se orientan hacia los lados de afuera.
Enlazantes
Los orbitales moleculares enlazantes son aquellos que contribuyen a la estabilidad de la molécula. Es decir, deben tener menos energía en comparación de los orbitales atómicos de los átomos individuales antes de enlazarse y formar la molécula. En estos orbitales los electrones se deslocalizan por todas las dimensiones de la molécula como un todo.
En los diagramas de OM, estos se ubicarán siempre por debajo de los orbitales atómicos que se combinaron para formarlos. Esto se verá con más detalle en los próximos apartados.
Antienlazantes
Los orbitales moleculares antienlazantes, por otro lado, son aquellos que desestabilizan la molécula. Se simbolizan con un asterisco (*), y sus energías son más altas que la de los orbitales atómicos que los originaron. En estos orbitales los electrones se deslocalizan de manera bastante irregular, como si la molécula estuviera electrónicamente fragmentada.
En los diagramas de OM, estos se ubicarán siempre por encima de los orbitales atómicos que se combinaron para formarlos.
No enlazantes
Mientras, los orbitales no enlazantes, así como sus electrones, son aquellos que no contribuyen ni perjudican la estabilidad de la molécula. Sus energías son muy similares a las de los orbitales atómicos.
Orden de enlace
El orden de enlace viene a ser en la teoría del orbital molecular, lo mismo que el número de enlace es en la teoría del enlace de valencia: una medida de la fuerza del enlace en una molécula. Así, un orden de enlace igual a 1, corresponde a un enlace simple (-). Y un orden de enlace (o.e) igual a 2, corresponde a un enlace doble (=). Así sucesivamente.
Este orden se determina a partir del conteo de los electrones en los diagramas de OM para una molécula en particular. Para ello, debe aplicarse la siguiente fórmula:
o.e = (Número de electrones enlazantes – Número de electrones antienlazantes)/2
Los electrones enlazantes contribuyen a que la molécula se estabilice, mientras que los electrones antienlazantes la desestabilizan. Por lo tanto, cuantos más electrones antienlazantes haya, menor será el o.e, y la molécula tenderá a ser muy inestable. Cuando el o.e es igual a 0, significa que la molécula no existe (o al menos en teoría).
Diagramas de OM
En los diagramas de OM se representan las energías de los orbitales moleculares, y se visualiza además su llenado electrónico, el cual obedece las reglas de Aufbauf y Hund, así como el principio de exclusión de Pauling. Considérese por ejemplo los siguientes dos diagramas:
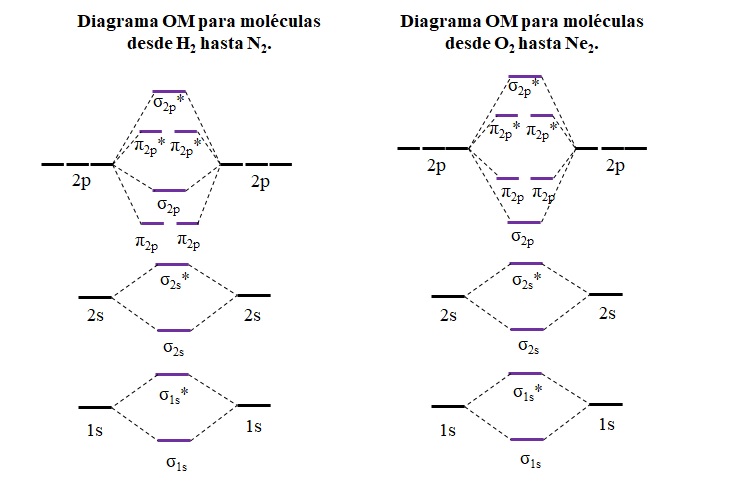
Las líneas horizontales en los laterales, de color negro, representan las energías de los orbitales atómicos. En cambio, las líneas horizontales centrales, de color morado, son las energías de los orbitales moleculares. Nótese cómo se distribuyen los OM enlanzantes y de antienlanzantes (*) en relación a los orbitales atómicos de los átomos individuales.
Nótese además que en el diagrama de la derecha, los OM σ2p cambian de lugar con π2p. Esto ocurre con las moléculas de O2, F2, y la hipotética Ne2.
Ejemplos
En los siguientes ejemplos se procederá a llenar los OM con los electrones, calcular el orden de enlace, y hacer predicciones sobre la fuerza del enlace o estabilidad de la molécula en cuestión.
H2
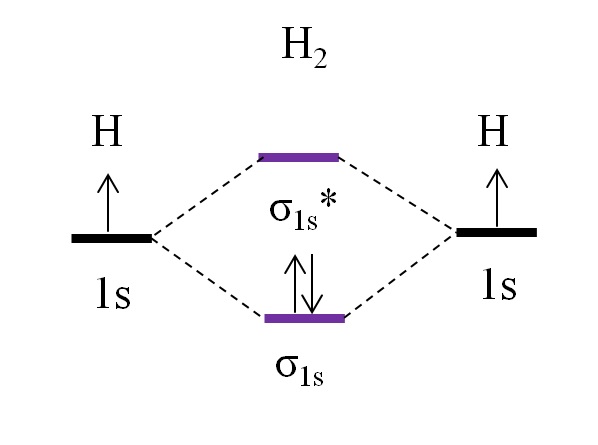
Empezando por la molécula más simple, la de dihidrógeno, H2, dos átomos H se enlazan combinando sus dos orbitales atómicos 1s para formar dos orbitales moleculares σ1s y σ1s*. Los dos electrones proceden entonces a llenar los orbitales moleculares.
Primero se llena el orbital σ1s, porque es el de menor energía (Regla de Aufbauf). Luego, el segundo electrón debe terminar de llenar el orbital σ1s antes de subir al orbital σ1s* (Regla de Hund). Y finalmente, este segundo electrón orienta su espín en el sentido contrario al primer electrón (principio de exclusión de Pauling). Así, los dos electrones se ubican en el orbital enlazante σ1s.
¿Qué hay del orden de enlace? En el orbital molecular enlazante σ1s tenemos 2 electrones; mientras que en el orbital molecular antienlazante σ1s* no tenemos ninguno. Por lo tanto, el cálculo quedaría como:
o.e = (2-0)/2
=1
Al ser o.e igual a 1, significa que el enlace que une a los dos átomos de hidrógeno es simple: H-H. Generalmente, si este valor es igual o superior a 1, se dice que la molécula existe y es estable.
He2
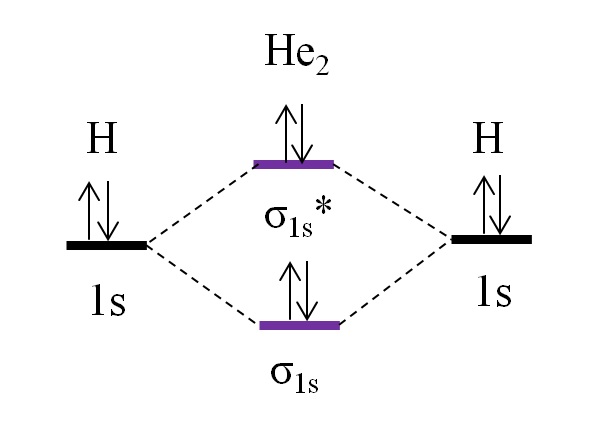
Ahora supóngase que se tiene la molécula de He2. Arriba vemos que su diagrama de OM es muy parecido al del H2, con 2 electrones adicionales que pasan a ubicarse en el orbital σ1s*. Al haber un total de 4 electrones sumando los dos átomos He, entonces debe haber también 4 electrones en todos los orbitales moleculares resultantes.
Determinando el o.e para la molécula de He2 tendremos:
o.e = (2-2)/2
= 0
Esto significa que no existe ningún enlace posible que una los dos átomos de helio. De hecho, hasta la fecha no ha podido identificarse la existencia de esta molécula, lo cual concuerda con las predicciones de la teoría del orbital molecular.
B2
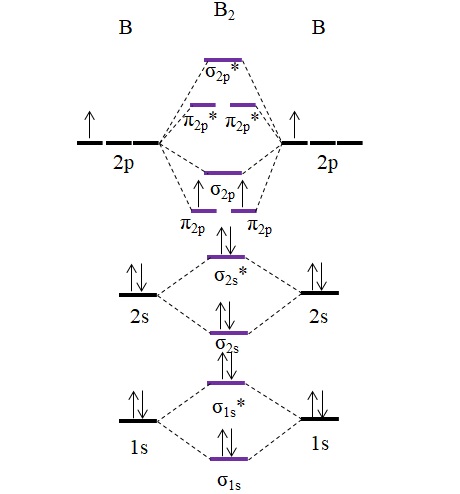
Nótese que en la formación de los orbitales moleculares también se toman en cuenta los electrones de las capas internas; no solo los de valencia.
Así, en el ejemplo de la molécula de diboro, B2, cada átomo de boro aporta 5 electrones en total, 3 de los cuales son de valencia; estos son, los de sus orbitales 2s y 2p. Los dos electrones de los orbitales 2p se posicionan en distintos orbitales moleculares π2p con espines paralelos (regla de Hund).
Procedemos entonces a calcular el orden de enlace:
o.e = (6-4)/2
=1
Por lo tanto, se espera que la molécula tenga un enlace simple B-B. El B2 es una molécula que solamente existe en la fase de vapor a muy altas temperaturas, porque el boro en condiciones normales adopta estructuras de redes y diseños más complejos.
C2 y C22-
Consideremos primero el diagrama de OM para la molécula C2:
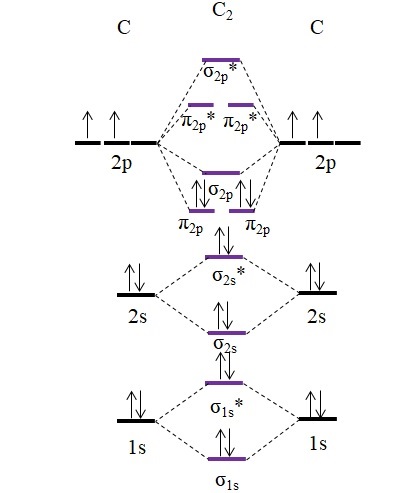
Ahora, los dos nuevos electrones aportados por los átomos de carbono se posicionan nuevamente en los orbitales moleculares π2p pero con espines opuestos (principio de exclusión de Pauling).
Determinando su orden de enlace tendremos:
o.e = (8-4)/2
= 2
Nótese que los orbitales moleculares π2p suman 4 electrones enlanzantes a la fórmula. Al ser este orden igual a 2, significa que la molécula C2 tiene un doble enlace, C=C. Otra vez, la molécula C2, llamada también carbono diatómico, existe solo en fase de vapor a altas temperaturas, y es una de las formas alotrópicas más simples del carbono.
¿Y qué hay del C22-? Su diagrama de OM es como sigue:
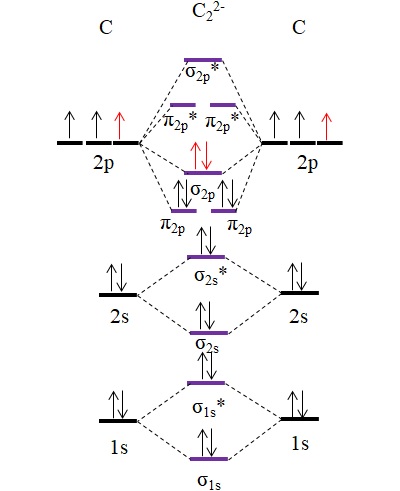
Los dos nuevos electrones (flechas rojas) se posicionan en el orbital molecular enlazante σ2p. Esto es así asumiendo que cada átomo de carbono aporta una de las dos cargas negativas (para un estado de oxidación de -1).
Calculando su orden de enlace tendremos:
o.e = (10-4)/2
= 3
Es decir, que el anión C22-, también llamado anión acetiluro, tiene un triple enlace, [C≡C]2-. Se trata de un anión relativamente estable con una gran fuerza de enlace; sin embargo, dependiendo de sus iones de contraparte, puede llegar a originar compuestos explosivos.
N2 y N2+
La famosa molécula del nitrógeno, N2, también puede describirse perfectamente mediante el uso de diagramas de orbitales moleculares:
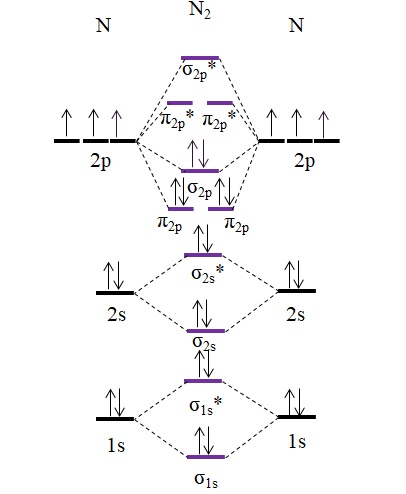
Nótese que este diagrama es exactamente el mismo que para el anión C22-. Esto significa que el N2 y C22- son isoelectrónicos. No obstante, tal hecho no implica que ambas especies se comporten del mismo modo. El N2, neutro, es mucho más estable que el C22-, negativo, aun cuando ambos tengan un orden de enlace igual a 3, N≡N.
¿Y qué hay del catión N2+? Veamos su diagrama de OM:
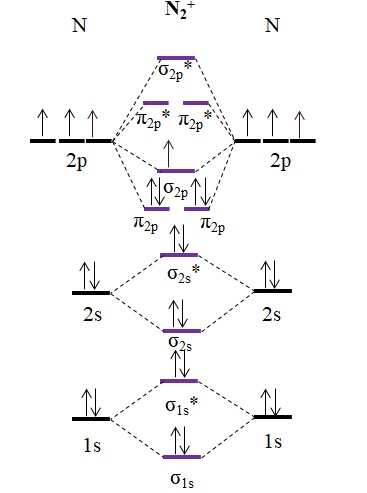
Como el catión N2+ tiene un electrón menos, este se remueve el orbital molecular σ2p. El N2 es diamagnético, mientras que el N2+ es paramagnético. Y su orden de enlace viene a ser:
o.e = (9-4)/2
=2.5
Un enlace de 2.5 se representaría con dos líneas y un punto. Sin embargo, tal cosa no tiene mucho sentido en la teoría del enlace de valencia o en las estructuras de Lewis. Debido a que este orden de enlace es menor a 3, la fuerza del enlace presente en el N2+ es inferior al del N2, por lo que es más inestable.
O2, O22- y O22+
Veamos ahora otra molécula muy importante para la vida: el oxígeno molecular o diatómico, O2. De acuerdo a la teoría del enlace de valencia y las estructuras de Lewis, debería ser diamagnético; pero experimentalmente se ha demostrado que es paramagnético, por lo que tiene electrones desapareados en alguna parte.
Abajo comparamos los diagramas de OM para el O2 y los iones O22- (óxido) y O22+ (oxidicatión):
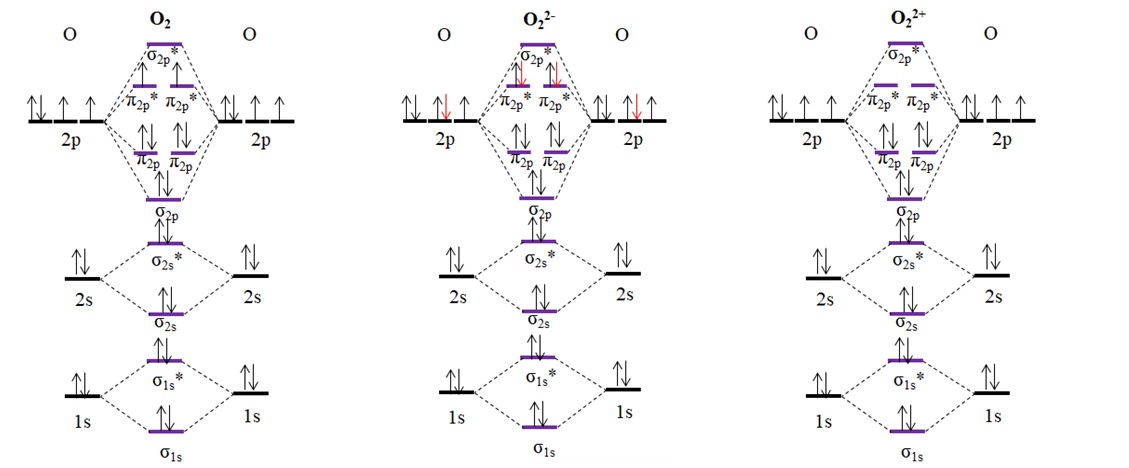
El diagrama de OM para el O2 muestra, a diferencia de los anteriores, que los orbitales moleculares σ2p y π2p cambian de posición energética. Asimismo, vemos efectivamente que hay dos electrones desapareados en los orbitales π2p*, lo cual explica el carácter paramagnético del oxígeno (mencionado al principio del artículo).
Por otro lado, tenemos también el diagrama de OM para el anión O22-, infinitamente difundido en el Cosmos (lunas, planetas, cometas, asteroides, etc.). Tiene dos electrones extras (flechas rojas), los cuales terminan de llenar los orbitales π2p*, apareando todos los electrones. En consecuencia, el O22- es diamagnético.
Igualmente, consideramos el diagrama de OM para el oxidicatión O22+. Tiene dos electrones menos que el O2, dejando vacíos los orbitales π2p*. Todos sus electrones están apareados, y por lo tanto es diamagnético.
Los órdenes de enlace para el O2, O22- y O22+ son, respectivamente: 2 (O=O), 1 [O-O]2- y 3 [O≡O]2+. Por lo tanto, el O22+ tendría el enlace más fuerte.
Ventajas y desventajas
Ventajas
Entre las ventajas de la teoría del orbital molecular podemos citar las siguientes:
-Permite evaluar órdenes de enlace que de ordinario no tendría mucho sentido en la teoría del enlace de valencia
-Se correlaciona bien con el diamagnetismo y paramagnetismo de las moléculas
-La distancia que separa los orbitales moleculares en los diagramas es igual a ΔE, y sirve para explicar las transiciones electrónicas producto de la absorción de fotones
-Aplica no solo para moléculas diatómicas homonucleares, sino también para moléculas heteronucleares, tales como el CO2 y el benceno
-Extiende su modelo hacia otros tipos de compuestos, como los complejos inorgánicos, por lo que sustenta la teoría del campo de los ligandos
-La consideración de que los electrones se deslocalizan por toda la molécula es conveniente para explicar muchas de las propiedades fisicoquímicas
Desventajas
Y entre algunas de las desventajas de la teoría del orbital molecular tenemos, para finalizar:
-Es muy abstracta y requiere de un profundo entendimiento matemático para comprenderla a plenitud
-Los diagramas para moléculas como CO2, CO, H2O y otras, pueden ser demasiados tediosos de elaborar y explicar
-No dice nada sobre regiones o enlaces específicos de una molécula grande
-Tampoco aporta ninguna información respecto a la geometría molecular (plano trigonal, plano cuadrada, tetraédrica, etc.).
-No resulta tan gráfica como la teoría del enlace de valencia
La teoría del orbital molecular, en conclusión, es una teoría que complementa a la teoría del enlace de valencia para tener un panorama más amplio y completo del espectro molecular.
Referencias
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2020). Molecular orbital theory. Recuperado de: en.wikipedia.org
- Stephen Lower. (07 de septiembre de 2020). Molecular Orbital Theory. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Steven A. Hardinger. (2017). Molecular Orbital Theory. Recuperado de: chemed.chem.purdue.edu
- Pressbooks. (s.f.). Chapter 8: Molecular Orbital Theory. Recuperado de: opentextbc.ca
